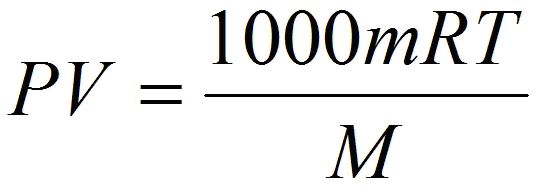|
|
|
| (3 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика и астрономия]]>>[[Физика 10 класс|Физика 10 класс]]>>Физика: Уравнение состояния идеального газа''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика и астрономия]]>>[[Физика 10 класс|Физика 10 класс]]>>Физика: Уравнение состояния идеального газа''' |
| - |
| |
| | <br> | | <br> |
| - |
| |
| | <metakeywords>Физика, 10 класс, Уравнение состояния, идеального газа</metakeywords> | | <metakeywords>Физика, 10 класс, Уравнение состояния, идеального газа</metakeywords> |
| | | | |
| - | Состояние газа данной массы характеризуется тремя макроскопическими параметрами: давлением ''p'', объемом ''V'' и температурой ''T''. Сейчас мы найдем между ними связь, а затем посмотрим, для чего эта связь нужна.<br> '''Уравнение состояния.''' Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (см. формулу 9.10). На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра ''p'', ''V'' и ''T'', характеризующие состояние достаточно разреженного газа данной массы. Это уравнение называют ''уравнением состояния идеального газа.''<br> Подставим в уравнение ''p=nkT ''выражение для концентрации молекул газа. Учитывая формулу (8.8), концентрацию газа можно записать так:<br>[[Image:A68-1.jpg|center|236x37px]]где ''N<sub>A</sub>'' - постоянная Авогадро; ''m'' - масса газа; ''M'' - его молярная масса.<br> После подстановки формулы (10.1) в выражение (9.10) будем иметь<br>[[Image:A68-2.jpg|center|213x32px]] Произведение постоянной Больцмана ''k'' и постоянной Авогадро ''N<sub>A</sub>'' называют '''универсальной (молярной) газовой постоянной''' и обозначают буквой ''R'':<br>[[Image:A68-3.jpg|center|508x41px]] Подставляя в уравнение (10.2) вместо ''kN<sub>A</sub>'' универсальную газовую постоянную ''R'', получим уравнение состояния для идеального газа произвольной массы:<br>[[Image:A68-4.jpg|center|215x47px]] Единственная величина в этом уравнении, зависящая от рода газа, - это его молярная масса.<br> Из ''уравнения состояния'' вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях.<br> Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 - параметры, относящиеся ко второму состоянию, то согласно уравнению (10.4) для газа данной массы<br>[[Image:A68-5.jpg|center|256x43px]] Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:<br>[[Image:A68-6.jpg|center|289x41px]] ''Уравнение состояния'' в форме (10.5) называется ''уравнением Клапейрона'' и представляет собой одну из форм записи уравнения состояния.<br> ''Уравнение состояния'' в форме (10.4) было впервые получено великим русским ученым Д. И. Менделеевым. Его называют уравнением Менделеева - Клапейрона.<br> '''Для чего нужно уравнение состояния?''' Не только идеальный газ, но и любая реальная система - газ, жидкость, твердое тело - характеризуется своим уравнением состояния. Но только эти уравнения намного сложнее, чем уравнение Менделеева - Клапейрона для идеального (достаточно разреженного) газа.<br> Знать уравнение состояния необходимо при исследовании тепловых явлений. Оно позволяет полностью или частично ответить сразу на три группы различных вопросов.<br> 1. Уравнение состояния позволяет определить одну из величин, характеризующих состояние, например температуру, если известны две другие величины. Это и используют в термометрах.<br> 2. Зная уравнение состояния, можно сказать, как протекают в системе различные процессы при определенных внешних условиях: например, как будет меняться давление газа, если увеличивать его объем при неизменной температуре, и т. д. Этому посвящен следующий параграф.<br> 3. Наконец, зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел. Об этом пойдет речь в конце раздела «Молекулярная физика. Тепловые явления».<br> Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной: ''R''=8,31Дж/(моль•К).<br><br><br> ???<br> 1. Что называют уравнением состояния?<br> 2. Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева - Клапейрона?<br> 3. Почему газовая постоянная ''R'' называется универсальной?<br>
| + | <h2>Состояние идеального газа</h2> |
| | | | |
| - | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс''
| + | Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Однако, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и соответственно они немного зависимы друг от друга. |
| | | | |
| - | <br> <sub>Материалы [[Физика и астрономия|по физике]], планирование по физике, задания и ответы по классам, планы конспектов уроков [[Физика 10 класс|по физике для 10 класса]]</sub>
| + | При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. Поэтому газовые законы и их следствия, как правило, не нарушаются лишь для разреженных реальных газов. То есть, для газов, расстояние между частицами которых ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально. |
| | | | |
| - | '''<u>Содержание урока</u>'''
| + | Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют. |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] конспект урока '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии
| + | |
| - |
| + | |
| - | '''<u>Практика</u>'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников
| + | |
| - |
| + | |
| - | '''<u>Иллюстрации</u>'''
| + | |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты
| + | |
| - |
| + | |
| - | '''<u>Дополнения</u>'''
| + | |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] рефераты'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие
| + | |
| - |
| + | |
| - | <u>Совершенствование учебников и уроков
| + | |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми
| + | |
| - |
| + | |
| - | '''<u>Только для учителей</u>'''
| + | |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения
| + | |
| - |
| + | |
| - |
| + | |
| - | '''<u>Интегрированные уроки</u>'''
| + | |
| - |
| + | |
| | | | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| + | Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. При таких обстоятельствах частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой. |
| | + | |
| | + | <h2>Уравнение состояния идеального газа</h2> |
| | + | |
| | + | А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, принято называть уравнением состояния идеального газа. |
| | + | |
| | + | К таким нулевым параметрам, без которых невозможно определить состояние газа, является: |
| | + | |
| | + | • К первому параметру относится давление, которое обозначают символом - Р;<br> |
| | + | • Второй параметр – это объем –V;<br> |
| | + | • И к третьему параметру относится температура – Т.<br> |
| | + | Из предыдущего раздела нашего урока, мы уже знаем, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных. |
| | + | |
| | + | А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще принято называть уравнением Клапейрона-Менделеева. |
| | + | |
| | + | Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа. |
| | + | |
| | + | PV = nRT |
| | + | |
| | + | Такое уравнение и называется уравнением состояния идеального газа. |
| | + | |
| | + | где: |
| | + | |
| | + | n – является числом молей газа;<br> |
| | + | P – давление газа, Па;<br> |
| | + | V – объем газа, м3;<br> |
| | + | T – абсолютная температура газа, К;<br> |
| | + | R – универсальная газовая постоянная 8,314 Дж/моль×K.<br> |
| | + | |
| | + | <br> |
| | + | [[Image:10kl_IdealGaz01.jpg|500x500px|уравнение газа]] |
| | + | <br> |
| | + | |
| | + | Впервые уравнение, которое помогает установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот Дмитрий Иванович Менделеев, великий русский ученый, в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон. |
| | + | |
| | + | Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона. |
| | + | |
| | + | Также, следует обратить внимание на то, что когда объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид: |
| | + | |
| | + | <br> |
| | + | [[Image:10kl_IdealGaz02.jpg|300x500px|уравнение газа]] |
| | + | <br> |
| | + | <br> |
| | + | [[Image:10kl_IdealGaz03.jpg|500x500px|уравнение газа]] |
| | + | <br> |
| | | | |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| + | Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете понятие о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям. |
Текущая версия на 14:24, 6 сентября 2015
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Уравнение состояния идеального газа
Состояние идеального газа
Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Однако, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и соответственно они немного зависимы друг от друга.
При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. Поэтому газовые законы и их следствия, как правило, не нарушаются лишь для разреженных реальных газов. То есть, для газов, расстояние между частицами которых ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально.
Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют.
Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. При таких обстоятельствах частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой.
Уравнение состояния идеального газа
А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, принято называть уравнением состояния идеального газа.
К таким нулевым параметрам, без которых невозможно определить состояние газа, является:
• К первому параметру относится давление, которое обозначают символом - Р;
• Второй параметр – это объем –V;
• И к третьему параметру относится температура – Т.
Из предыдущего раздела нашего урока, мы уже знаем, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных.
А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще принято называть уравнением Клапейрона-Менделеева.
Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа.
PV = nRT
Такое уравнение и называется уравнением состояния идеального газа.
где:
n – является числом молей газа;
P – давление газа, Па;
V – объем газа, м3;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
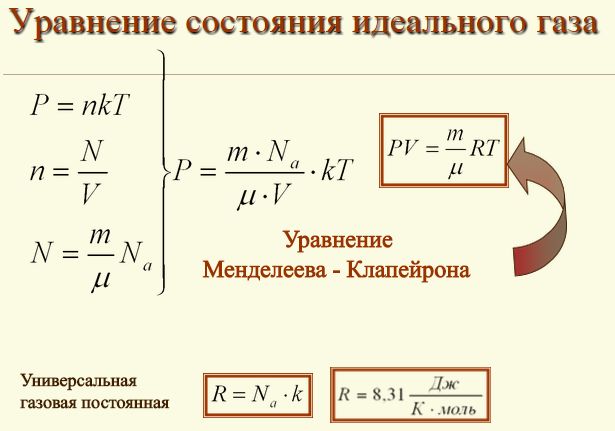
Впервые уравнение, которое помогает установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот Дмитрий Иванович Менделеев, великий русский ученый, в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон.
Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона.
Также, следует обратить внимание на то, что когда объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид:
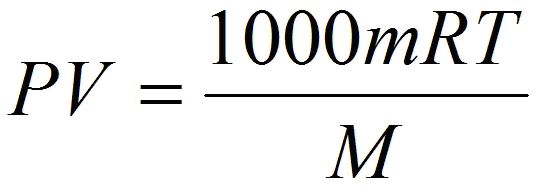

Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете понятие о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям.
|