|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Фізичні властивості оксидів. Класифiкація оксидів. Оксиди в природі. Використання оксидів''' <metakeywords>Хімія, клас, урок, на Тему, Фізичні властивості оксидів, Класифiкація оксидів, Оксиди в природі, Використання оксидів </metakeywords> <br> | | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Фізичні властивості оксидів. Класифiкація оксидів. Оксиди в природі. Використання оксидів''' <metakeywords>Хімія, клас, урок, на Тему, Фізичні властивості оксидів, Класифiкація оксидів, Оксиди в природі, Використання оксидів </metakeywords> <br> |
| | | | |
| | + | <br> |
| | | | |
| | + | <u>Тобі треба<br>знати:</u> фізичні властивості оксидів; класифікацію оксидів; хімічну властивість оксидів — взаємодію з водою;<br><u>вміти:</u> записувати рівняння реакцій взаємодії оксидів із водою.<br><br><br>'''Фізичні властивості.''' Оксиди мають різні фізичні властивості. За стандартних умов більшість оксидів — тверді речовини (BaO, CuO, Р<sub>2</sub>О<sub>5</sub>), деякі — рідкі (Сl<sub>2</sub>0<sub>7</sub>, Н<sub>2</sub>0) і газуваті (С0<sub>2</sub>, N0). Мають різний колір. Густина, температури плавлення і кипіння змінюються в широких межах.<br> |
| | | | |
| - | <u>Тобі треба<br>знати:</u> фізичні властивості оксидів; класифікацію оксидів; хімічну властивість оксидів — взаємодію з водою;<br><u>вміти:</u> записувати рівняння реакцій взаємодії оксидів із водою.<br><br><br>'''Фізичні властивості.''' Оксиди мають різні фізичні властивості. За стандартних умов більшість оксидів — тверді речовини (BaO, CuO, Р<sub>2</sub>О<sub>5</sub>), деякі — рідкі (Сl<sub>2</sub>0<sub>7</sub>, Н<sub>2</sub>0) і газуваті (С0<sub>2</sub>, N0). Мають різний колір. Густина, температури плавлення і кипіння змінюються в широких межах.<br>
| + | <br> |
| | | | |
| | + | '''Хімічні властивості.''' За хімічними властивостями оксиди поділяють на солетворні та несолетворні, або байдужі. Несолетворних оксидів дуже мало, це — CO, SiO, NO, N<sub>2</sub>0. Вони не утворюють солей.<br> |
| | | | |
| | + | Оксиди за складом класифікують на оксиди металів і оксиди неметалів. Дізнаємося, як вони ставляться до води.<br> |
| | | | |
| - | '''Хімічні властивості.''' За хімічними властивостями оксиди поділяють на солетворні та несолетворні, або байдужі. Несолетворних оксидів дуже мало, це — CO, SiO, NO, N<sub>2</sub>0. Вони не утворюють солей.<br>
| + | <br> |
| | | | |
| - | Оксиди за складом класифікують на оксиди металів і оксиди неметалів. Дізнаємося, як вони ставляться до води.<br>
| + | {| cellspacing="1" cellpadding="1" border="1" style="width: 279px; height: 194px;" |
| - | | + | |
| - | | + | |
| - | | + | |
| - | {| cellspacing="1" cellpadding="1" border="1" style="width: 279px; height: 223px;" | + | |
| | |- | | |- |
| | | ''Приклади оксидів металів:'' <br> магній оксид МgО (білого кольору)<br> нікол(ІІ) оксид NiO (темно-зеленого кольору)<br> ферум(ІІІ) оксид Fe<sub>2</sub>O<sub>3</sub> (бурого кольору)<br> <br> ''Приклади оксидів неметалів:'' <br> нітроген(ІV) оксид NO<sub>2</sub> (бурого кольору)<br> хлop(IV) оксид СlO<sub>2</sub> (зеленкувато-жовтого кольору) <br> силіцій(ІV) оксид SiO<sub>2</sub> (безбарвний) | | | ''Приклади оксидів металів:'' <br> магній оксид МgО (білого кольору)<br> нікол(ІІ) оксид NiO (темно-зеленого кольору)<br> ферум(ІІІ) оксид Fe<sub>2</sub>O<sub>3</sub> (бурого кольору)<br> <br> ''Приклади оксидів неметалів:'' <br> нітроген(ІV) оксид NO<sub>2</sub> (бурого кольору)<br> хлop(IV) оксид СlO<sub>2</sub> (зеленкувато-жовтого кольору) <br> силіцій(ІV) оксид SiO<sub>2</sub> (безбарвний) |
| - |
| |
| | |} | | |} |
| | | | |
| - | Дослід 1. У порцелянову чашку поміщаємо грудочки свіжопрожареного кальцій оксиду СаО (негашене вапно) і доливаємо до нього води (мал. 3). Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)<sub>2</sub>. Виділення теплоти засвідчує, що відбулася реакція. Запиши рівняння цієї реакції:<br>СаО + Н<sub>2</sub>0 = Са(ОН)<sub>2</sub><br> | + | Дослід 1. У порцелянову чашку поміщаємо грудочки свіжопрожареного кальцій оксиду СаО (негашене вапно) і доливаємо до нього води (мал. 3). Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)<sub>2</sub>. Виділення теплоти засвідчує, що відбулася реакція. Запиши рівняння цієї реакції:<br>СаО + Н<sub>2</sub>0 = Са(ОН)<sub>2</sub><br> |
| | | | |
| - | [[Файл:Мал. 3. Гашення вапна.jpg]]<br>Мал. 3. Гашення вапна<br><br>• Пригадай, як називаються реакції, що відбуваються з виділенням теплоти.<br>Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів, наприклад оксиди Натрію, Літію, Барію:<br>Na<sub>2</sub>0 + Н<sub>2</sub>0 = 2NaOH <br> Натрій гідроксид<br>Li<sub>2</sub>0 + Н<sub>2</sub>0 = 2LiOH <br> Літій гідроксид<br>ВаО + Н<sub>2</sub>0 = Ва(ОН)<sub>2</sub><br> Барій гідроксид<br> | + | [[Image:Мал. 3. Гашення вапна.jpg]]<br>Мал. 3. Гашення вапна<br><br>• Пригадай, як називаються реакції, що відбуваються з виділенням теплоти.<br>Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів, наприклад оксиди Натрію, Літію, Барію:<br>Na<sub>2</sub>0 + Н<sub>2</sub>0 = 2NaOH <br> Натрій гідроксид<br>Li<sub>2</sub>0 + Н<sub>2</sub>0 = 2LiOH <br> Літій гідроксид<br>ВаО + Н<sub>2</sub>0 = Ва(ОН)<sub>2</sub><br> Барій гідроксид<br> |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" style="width: 352px; height: 122px;" | | {| cellspacing="1" cellpadding="1" border="1" style="width: 352px; height: 122px;" |
| | |- | | |- |
| | | | | | |
| - | Приклади оксидів металів, що взаємодіють з водою'':''<br> натрій оксид Na<sub>2</sub>0 <br> літій оксид Li<sub>2</sub>0 <br> барій оксид ВаО <br> кальцій оксид СаО | + | ''Приклади оксидів металів, що взаємодіють з водою:''<br> натрій оксид Na<sub>2</sub>0 <br> літій оксид Li<sub>2</sub>0 <br> барій оксид ВаО <br> кальцій оксид СаО |
| | | | |
| | |} | | |} |
| | | | |
| - | ''<br>''<br>Гідроксиди металів називають основами. Основи, як і оксиди, утворюють клас неорганічних сполук.<br> | + | ''<br>''<br>Гідроксиди металів називають основами. Основи, як і оксиди, утворюють клас неорганічних сполук.<br> |
| | | | |
| - | Не всі оксиди металів безпосередньо реагують з водою. Більшість із них, наприклад CuO, Fe<sub>2</sub>O<sub>3</sub>, Аl<sub>2</sub>O<sub>3</sub> | + | Не всі оксиди металів безпосередньо реагують з водою. Більшість із них, наприклад CuO, Fe<sub>2</sub>O<sub>3</sub>, Аl<sub>2</sub>O<sub>3</sub>, з водою не взаємодіє. То, може, відповідні цим оксидам гідроксиди (основи) не існують? Існують, але їх добувають непрямим шляхом, як саме — дізнаєшся далі. А поки що зверни увагу на формули гідроксидів металів, що відповідають оксидам: |
| | | | |
| - | ''Оксиди металів, що не взаємодіють з водою''<br>CuO — купрум(ІІ) оксид <br>Fe<sub>2</sub>O<sub>3</sub> — ферум(ІІІ) оксид <br>Аl<sub>2</sub>O<sub>3</sub> — алюміній оксид <br> | + | ''Оксиди металів, що не взаємодіють з водою''<br>CuO — купрум(ІІ) оксид <br>Fe<sub>2</sub>O<sub>3</sub> — ферум(ІІІ) оксид <br>Аl<sub>2</sub>O<sub>3</sub> — алюміній оксид <br> |
| | | | |
| - | ''Нерозчинні основи — гідроксиди металів''<br>Си(ОН)<sub>2</sub> — купрум(ІІ) гідроксид <br>Fe(OH)<sub>3</sub> — ферум(ІІІ) гідроксид <br>Аl(ОН)<sub>3</sub> — алюміній гідроксид <br>Zn(OH)<sub>2</sub> — цинк гідроксид<br><br> | + | ''Нерозчинні основи — гідроксиди металів''<br>Сu(ОН)<sub>2</sub> — купрум(ІІ) гідроксид <br>Fe(OH)<sub>3</sub> — ферум(ІІІ) гідроксид <br>Аl(ОН)<sub>3</sub> — алюміній гідроксид <br>Zn(OH)<sub>2</sub> — цинк гідроксид<br><br> |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" style="width: 361px; height: 104px;" | | {| cellspacing="1" cellpadding="1" border="1" style="width: 361px; height: 104px;" |
| | |- | | |- |
| | | | | | |
| - | Приклади оксидів металів, що не взаємодіють з водою:<br> плюмбум(ІІ) оксид РЬО <br> хром(ІІ) оксид СrO <br> манган(ІІ) оксид МnО <br> ферум(ІІ) оксид FeO | + | ''Приклади оксидів металів, що не взаємодіють з водою:''<br> плюмбум(ІІ) оксид РЬО <br> хром(ІІ) оксид СrO <br> манган(ІІ) оксид МnО <br> ферум(ІІ) оксид FeO |
| | | | |
| | |} | | |} |
| | | | |
| - | <br>Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними. | + | <br>Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними. |
| | | | |
| - | Усі основні оксиди за стандартних умов — тверді речовини. | + | Усі основні оксиди за стандартних умов — тверді речовини. |
| | | | |
| - | Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними.<br><br>Дослід 2. У порцелянову чашку поміщаємо фосфор(V) оксид і додаємо води. Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ор-тофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота:<br>Р<sub>2</sub>0<sub>5</sub> + Н<sub>2</sub>0 = 2НР0<sub>3</sub><br> холодна Метафосфатна кислота<br>Р<sub>2</sub>0<sub>5</sub> + ЗН<sub>2</sub>0 = 2Н<sub>3</sub>Р0<sub>4</sub><br> гаряча Ортофосфатна кислота<br> | + | Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними.<br><br>Дослід 2. У порцелянову чашку поміщаємо фосфор(V) оксид і додаємо води. Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ор-тофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота:<br>Р<sub>2</sub>0<sub>5</sub> + Н<sub>2</sub>0 = 2НР0<sub>3</sub><br> холодна Метафосфатна кислота<br>Р<sub>2</sub>0<sub>5</sub> + ЗН<sub>2</sub>0 = 2Н<sub>3</sub>Р0<sub>4</sub><br> гаряча Ортофосфатна кислота<br> |
| - | | + | |
| - | Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду С0<sub>2</sub> або сульфур(VI) оксиду SO<sub>3</sub>, також утворюються кислоти. Кислоти — це також певний клас неорганічних сполук:<br>CO<sub>2</sub> + H<sub>2</sub>O = H<sub>2</sub>CO<sub>3</sub><br>Карбонатна кислота<br>SO<sub>3</sub> + Н<sub>2</sub>O = H<sub>2</sub>SO<sub>4</sub><br>Сульфатна кислота<br>• До якого типу належать розглянуті реакції взаємодії оксидів металів і неметалів з водою?<br>
| + | |
| | | | |
| | + | Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду С0<sub>2</sub> або сульфур(VI) оксиду SO<sub>3</sub>, також утворюються кислоти. Кислоти — це також певний клас неорганічних сполук:<br>CO<sub>2</sub> + H<sub>2</sub>O = H<sub>2</sub>CO<sub>3</sub><br>Карбонатна кислота<br>SO<sub>3</sub> + Н<sub>2</sub>O = H<sub>2</sub>SO<sub>4</sub><br>Сульфатна кислота<br>• До якого типу належать розглянуті реакції взаємодії оксидів металів і неметалів з водою?<br> |
| | | | |
| | + | <br> |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" style="width: 368px; height: 136px;" | | {| cellspacing="1" cellpadding="1" border="1" style="width: 368px; height: 136px;" |
| | |- | | |- |
| | | | | | |
| - | Приклади оксидів неметалів, що взаємодіють з водою:<br> сульфур(ІV) оксид SO<sub>2</sub> | + | ''Приклади оксидів неметалів, що взаємодіють з водою:''<br> сульфур(ІV) оксид SO<sub>2</sub> |
| | | | |
| - | сульфур(VІ) оксид SO<sub>3</sub> <br> карбон(ІV) оксид СO<sub>2</sub> <br> фосфор(V) оксид Р<sub>2</sub>0<sub>5</sub> | + | сульфур(VІ) оксид SO<sub>3</sub> <br> карбон(ІV) оксид СO<sub>2</sub> <br> фосфор(V) оксид Р<sub>2</sub>0<sub>5</sub> |
| | | | |
| | |} | | |} |
| | | | |
| - | <br>Під час взаємодії з водою багатьох оксидів неметалів утворюються кислоти<br> | + | <br>Під час взаємодії з водою багатьох оксидів неметалів утворюються кислоти<br> |
| - | | + | |
| - | Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними<br>
| + | |
| | | | |
| | + | Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними<br> |
| | | | |
| | + | <br> |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" style="width: 369px; height: 95px;" | | {| cellspacing="1" cellpadding="1" border="1" style="width: 369px; height: 95px;" |
| | |- | | |- |
| | | | | | |
| - | Приклади кислотних оксидів, які за стандартних умов:<br> тверді — фосфор(V) оксид Р<sub>2</sub>O<sub>5</sub> <br> рідкі — нітроген(ІІІ) оксид N<sub>2</sub>O<sub>3</sub> <br> газуваті — сульфур(ІV) оксид SO<sub>2</sub> | + | ''Приклади кислотних оксидів, які за стандартних умов:''<br> тверді — фосфор(V) оксид Р<sub>2</sub>O<sub>5</sub> <br> рідкі — нітроген(ІІІ) оксид N<sub>2</sub>O<sub>3</sub> <br> газуваті — сульфур(ІV) оксид SO<sub>2</sub> |
| | | | |
| | |} | | |} |
| | | | |
| - | <br><br>Виникає запитання, чи всі оксиди неметалів розчиняються у воді, утворюючи кислоти? Ні, не всі. Наприклад, силіцій(IV) оксид Si0<sub>2</sub> (річковий пісок) у воді не розчиняється й кислоти у такий спосіб не утворює. Але це не означає, що силікатна кислота H<sub>2</sub>Si0<sub>3</sub> не існує. Вона так само, як і інші нерозчинні кислоти, що відповідають нерозчинним оксидам неметалів, може бути добута непрямим шляхом.<br>Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними.<br>Про інші хімічні властивості оксидів ти дізнаєшся пізніше.<br><br><br><u>ВИСНОВКИ</u><br>Оксиди активних металів взаємодіють з водою, утворюючи розчинні гідроксиди металів, або основи.<br>Оксиди металів, яким відповідають основи, називаються основними оксидами.<br>Оксиди неметалів взаємодіють з водою, утворюючи розчинні кислоти.<br>Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами.<br>Кислотним і основним оксидам, що не розчиняються у воді, відповідають нерозчинні кислоти й нерозчинні основи. Кислотні й основні оксиди — солетворні.<br><br><br><u>Завдання для самоконтролю</u><br>1. Розстав коефіцієнти у таких схемах хімічних реакцій:<br>Na<sub>2</sub>O + Н<sub>2</sub>O → NaOH <br>Сl<sub>2</sub>O<sub>7</sub> + Н<sub>2</sub>O → НСlО<sub>4</sub> <br>N<sub>2</sub>O<sub>5</sub> + H<sub>2</sub>O → HN0<sub>3</sub><br>2. Які з наведених речовин можуть реагувати з водою: барій оксид, натрій оксид, сульфур(І\/) оксид, купрум(ІІ) оксид, силіцій(І\/) оксид, сульфур(\/І) оксид? Напиши рівняння реакцій.<br>3. Напиши рівняння реакцій, що відповідають таким перетворенням: а) Са → СаО → Са(ОН)<sub>2</sub>; б) С → С0<sub>2</sub> → Н<sub>2</sub>С0<sub>3</sub>.<br>4. Обчисди масові частки елементів у натрій оксиді. | + | <br><br>Виникає запитання, чи всі оксиди неметалів розчиняються у воді, утворюючи кислоти? Ні, не всі. Наприклад, силіцій(IV) оксид Si0<sub>2</sub> (річковий пісок) у воді не розчиняється й кислоти у такий спосіб не утворює. Але це не означає, що силікатна кислота H<sub>2</sub>Si0<sub>3</sub> не існує. Вона так само, як і інші нерозчинні кислоти, що відповідають нерозчинним оксидам неметалів, може бути добута непрямим шляхом.<br>Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними.<br>Про інші хімічні властивості оксидів ти дізнаєшся пізніше.<br><br><br><u>ВИСНОВКИ</u><br>Оксиди активних металів взаємодіють з водою, утворюючи розчинні гідроксиди металів, або основи.<br>Оксиди металів, яким відповідають основи, називаються основними оксидами.<br>Оксиди неметалів взаємодіють з водою, утворюючи розчинні кислоти.<br>Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами.<br>Кислотним і основним оксидам, що не розчиняються у воді, відповідають нерозчинні кислоти й нерозчинні основи. Кислотні й основні оксиди — солетворні.<br><br><br><u>Завдання для самоконтролю</u><br>1. Розстав коефіцієнти у таких схемах хімічних реакцій:<br>Na<sub>2</sub>O + Н<sub>2</sub>O → NaOH <br>Сl<sub>2</sub>O<sub>7</sub> + Н<sub>2</sub>O → НСlО<sub>4</sub> <br>N<sub>2</sub>O<sub>5</sub> + H<sub>2</sub>O → HN0<sub>3</sub><br>2. Які з наведених речовин можуть реагувати з водою: барій оксид, натрій оксид, сульфур(І\/) оксид, купрум(ІІ) оксид, силіцій(І\/) оксид, сульфур(\/І) оксид? Напиши рівняння реакцій.<br>3. Напиши рівняння реакцій, що відповідають таким перетворенням: а) Са → СаО → Са(ОН)<sub>2</sub>; б) С → С0<sub>2</sub> → Н<sub>2</sub>С0<sub>3</sub>.<br>4. Обчисди масові частки елементів у натрій оксиді. |
| | | | |
| - | <br><u>Додаткові завдання</u><br>5. Яку масу свинцевої руди треба взяти для добування свинцю масою 10 т? Припускаємо, що домішок немає і руда являє собою чистий свинцевий блиск PbS.<br>6*. Визнач кількість речовини карбон(І\/) оксиду, необхідного для повної взаємодії з водою масою 1,8 г.<br>7*. Унаслідок спалювання металу масою 3 г утворився його оксид масою 4,2 г, в якому валентність атома металу 2. Який це метал?<br>8*. Виведи формулу одного з оксидів Мангану, якщо відомо, що співвідношення маси Мангану в ньому до маси Оксигену становить 1:1.<br> | + | <br><u>Додаткові завдання</u><br>5. Яку масу свинцевої руди треба взяти для добування свинцю масою 10 т? Припускаємо, що домішок немає і руда являє собою чистий свинцевий блиск PbS.<br>6*. Визнач кількість речовини карбон(І\/) оксиду, необхідного для повної взаємодії з водою масою 1,8 г.<br>7*. Унаслідок спалювання металу масою 3 г утворився його оксид масою 4,2 г, в якому валентність атома металу 2. Який це метал?<br>8*. Виведи формулу одного з оксидів Мангану, якщо відомо, що співвідношення маси Мангану в ньому до маси Оксигену становить 1:1.<br> |
| | | | |
| | ---- | | ---- |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту | + | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту |
| | | | |
| - | <br> <sub>Повний перелік тем по [[Гіпермаркет_Знань_-_перший_в_світі!|класам]], календарний план згідно шкільної програми з [[Хімія|хімії]], курси та завдання з хімії для 8 класу</sub> <br> | + | <br> <sub>Повний перелік тем по [[Гіпермаркет Знань - перший в світі!|класам]], календарний план згідно шкільної програми з [[Хімія|хімії]], курси та завдання з хімії для 8 класу</sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
Версия 19:48, 30 ноября 2009
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Фізичні властивості оксидів. Класифiкація оксидів. Оксиди в природі. Використання оксидів
Тобі треба
знати: фізичні властивості оксидів; класифікацію оксидів; хімічну властивість оксидів — взаємодію з водою;
вміти: записувати рівняння реакцій взаємодії оксидів із водою.
Фізичні властивості. Оксиди мають різні фізичні властивості. За стандартних умов більшість оксидів — тверді речовини (BaO, CuO, Р2О5), деякі — рідкі (Сl207, Н20) і газуваті (С02, N0). Мають різний колір. Густина, температури плавлення і кипіння змінюються в широких межах.
Хімічні властивості. За хімічними властивостями оксиди поділяють на солетворні та несолетворні, або байдужі. Несолетворних оксидів дуже мало, це — CO, SiO, NO, N20. Вони не утворюють солей.
Оксиди за складом класифікують на оксиди металів і оксиди неметалів. Дізнаємося, як вони ставляться до води.
Приклади оксидів металів:
магній оксид МgО (білого кольору)
нікол(ІІ) оксид NiO (темно-зеленого кольору)
ферум(ІІІ) оксид Fe2O3 (бурого кольору)
Приклади оксидів неметалів:
нітроген(ІV) оксид NO2 (бурого кольору)
хлop(IV) оксид СlO2 (зеленкувато-жовтого кольору)
силіцій(ІV) оксид SiO2 (безбарвний)
|
Дослід 1. У порцелянову чашку поміщаємо грудочки свіжопрожареного кальцій оксиду СаО (негашене вапно) і доливаємо до нього води (мал. 3). Спостерігається таке сильне розігрівання, що частина води перетворюється на пару, а грудочки розсипаються, перетворюючись на сухий пухкий порошок — гашене вапно, або кальцій гідроксид Са(ОН)2. Виділення теплоти засвідчує, що відбулася реакція. Запиши рівняння цієї реакції:
СаО + Н20 = Са(ОН)2
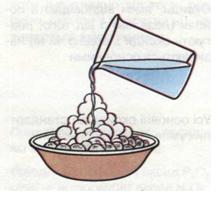
Мал. 3. Гашення вапна
• Пригадай, як називаються реакції, що відбуваються з виділенням теплоти.
Так само, як кальцій оксид, сполучаються з водою й оксиди інших активних металів, наприклад оксиди Натрію, Літію, Барію:
Na20 + Н20 = 2NaOH
Натрій гідроксид
Li20 + Н20 = 2LiOH
Літій гідроксид
ВаО + Н20 = Ва(ОН)2
Барій гідроксид
|
Приклади оксидів металів, що взаємодіють з водою:
натрій оксид Na20
літій оксид Li20
барій оксид ВаО
кальцій оксид СаО
|
Гідроксиди металів називають основами. Основи, як і оксиди, утворюють клас неорганічних сполук.
Не всі оксиди металів безпосередньо реагують з водою. Більшість із них, наприклад CuO, Fe2O3, Аl2O3, з водою не взаємодіє. То, може, відповідні цим оксидам гідроксиди (основи) не існують? Існують, але їх добувають непрямим шляхом, як саме — дізнаєшся далі. А поки що зверни увагу на формули гідроксидів металів, що відповідають оксидам:
Оксиди металів, що не взаємодіють з водою
CuO — купрум(ІІ) оксид
Fe2O3 — ферум(ІІІ) оксид
Аl2O3 — алюміній оксид
Нерозчинні основи — гідроксиди металів
Сu(ОН)2 — купрум(ІІ) гідроксид
Fe(OH)3 — ферум(ІІІ) гідроксид
Аl(ОН)3 — алюміній гідроксид
Zn(OH)2 — цинк гідроксид
|
Приклади оксидів металів, що не взаємодіють з водою:
плюмбум(ІІ) оксид РЬО
хром(ІІ) оксид СrO
манган(ІІ) оксид МnО
ферум(ІІ) оксид FeO
|
Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними.
Усі основні оксиди за стандартних умов — тверді речовини.
Оксиди, яким відповідають основи (незалежно від того, реагують оксиди з водою чи ні) називаються основними.
Дослід 2. У порцелянову чашку поміщаємо фосфор(V) оксид і додаємо води. Реакція також екзотермічна. Суміш розігрівається так, що вода закипає. Утворюється нова речовина — фосфатна, або ор-тофосфатна, кислота. Якщо вода холодна, то утворюється метафосфатна кислота:
Р205 + Н20 = 2НР03
холодна Метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча Ортофосфатна кислота
Під час взаємодії з водою багатьох оксидів неметалів, наприклад карбон(IV) оксиду С02 або сульфур(VI) оксиду SO3, також утворюються кислоти. Кислоти — це також певний клас неорганічних сполук:
CO2 + H2O = H2CO3
Карбонатна кислота
SO3 + Н2O = H2SO4
Сульфатна кислота
• До якого типу належать розглянуті реакції взаємодії оксидів металів і неметалів з водою?
|
Приклади оксидів неметалів, що взаємодіють з водою:
сульфур(ІV) оксид SO2
сульфур(VІ) оксид SO3
карбон(ІV) оксид СO2
фосфор(V) оксид Р205
|
Під час взаємодії з водою багатьох оксидів неметалів утворюються кислоти
Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними
|
Приклади кислотних оксидів, які за стандартних умов:
тверді — фосфор(V) оксид Р2O5
рідкі — нітроген(ІІІ) оксид N2O3
газуваті — сульфур(ІV) оксид SO2
|
Виникає запитання, чи всі оксиди неметалів розчиняються у воді, утворюючи кислоти? Ні, не всі. Наприклад, силіцій(IV) оксид Si02 (річковий пісок) у воді не розчиняється й кислоти у такий спосіб не утворює. Але це не означає, що силікатна кислота H2Si03 не існує. Вона так само, як і інші нерозчинні кислоти, що відповідають нерозчинним оксидам неметалів, може бути добута непрямим шляхом.
Оксиди, яким відповідають кислоти (незалежно від того, реагують оксиди з водою чи ні), називаються кислотними.
Про інші хімічні властивості оксидів ти дізнаєшся пізніше.
ВИСНОВКИ
Оксиди активних металів взаємодіють з водою, утворюючи розчинні гідроксиди металів, або основи.
Оксиди металів, яким відповідають основи, називаються основними оксидами.
Оксиди неметалів взаємодіють з водою, утворюючи розчинні кислоти.
Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами.
Кислотним і основним оксидам, що не розчиняються у воді, відповідають нерозчинні кислоти й нерозчинні основи. Кислотні й основні оксиди — солетворні.
Завдання для самоконтролю
1. Розстав коефіцієнти у таких схемах хімічних реакцій:
Na2O + Н2O → NaOH
Сl2O7 + Н2O → НСlО4
N2O5 + H2O → HN03
2. Які з наведених речовин можуть реагувати з водою: барій оксид, натрій оксид, сульфур(І\/) оксид, купрум(ІІ) оксид, силіцій(І\/) оксид, сульфур(\/І) оксид? Напиши рівняння реакцій.
3. Напиши рівняння реакцій, що відповідають таким перетворенням: а) Са → СаО → Са(ОН)2; б) С → С02 → Н2С03.
4. Обчисди масові частки елементів у натрій оксиді.
Додаткові завдання
5. Яку масу свинцевої руди треба взяти для добування свинцю масою 10 т? Припускаємо, що домішок немає і руда являє собою чистий свинцевий блиск PbS.
6*. Визнач кількість речовини карбон(І\/) оксиду, необхідного для повної взаємодії з водою масою 1,8 г.
7*. Унаслідок спалювання металу масою 3 г утворився його оксид масою 4,2 г, в якому валентність атома металу 2. Який це метал?
8*. Виведи формулу одного з оксидів Мангану, якщо відомо, що співвідношення маси Мангану в ньому до маси Оксигену становить 1:1.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Повний перелік тем по класам, календарний план згідно шкільної програми з хімії, курси та завдання з хімії для 8 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











