|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Розрахунки за хімічними рівняннями об'єму речовини
Тобі треба
знати: алгоритм розв'язування розрахункової задачі;
уміти обчислювати: об'єм газуватої речовини (н. у.) за відомою масою або кількістю речовини.
Ти вже знаєш, що хімічне рівняння — умовний запис хімічної реакції за допомогою хімічних формул. Його складають на основі закону збереження маси речовин, згідно з яким маса речовин, що вступають у реакцію, дорівнює масі речовин, що утворюються внаслідок реакції. Добираючи коефіцієнти до формул речовин, ти зрівнюєш число атомів кожного елемента в лівій і правій частинах і дістаєш хімічне рівняння, що відповідає закону збереження маси.
Пам'ятай! Для розрахунків важливо обирати такі одиниці вимірювання маси, об'єму, кількості речовини, які відповідають одна одній
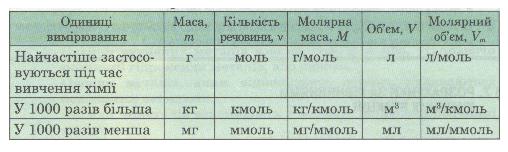
За хімічним рівнянням можна робити різні розрахунки — обчислювати кількість речовини, масу, об'єм вихідних речовин або продуктів реакції. Для цього потрібно спочатку записати скорочену умову задачі, правильно використовуючи фізичні величини і їх позначення (табл. 2).
Таблиця 2. Співвідношення деяких фізико-хімічних величин та одиниць вимірювання
Приклад. Який об'єм кисню (н. у.) необхідний для окиснення алюмінію масою 54 г?
Дано:
m(Аl) = 54 г
V(O2) — ?
Варіант 1
4Аl + 3O2 = 2Аl2O3
_______ _______
v = 4 моль v = 3 моль
М = 27 г/моль Vm = 22,4 л/моль
V = 22,4 л/моль • 3 моль = 67,2 л
v = m/M; v(Al) = (54 г)/(27 г/моль) = 2 моль
4 моль : 2 моль = 67,2 л : х;
х = (2 моль • 67,2 л)/(4 моль) = 33,6 л.
Відповідь. Для окиснення алюмінію масою 54 г необхідно витратити кисень об'ємом 33,6 л (н. у.) (V(O2) = 33,6 л).
Варіант 2
54 г х
4Аl + 3О2 = 2Аl2O3
___________________ _____________________
v = 4 моль v = 3 моль
М = 27 г/моль Vm = 22,4 л/моль
m = 27 г/моль•4 моль = 108 г V = 22,4 л/моль•3 моль = 67,2 л
108 г : 54 г = 67,2 л : х;
x = (54г • 67,2 л)/(108 г) = 33,6 л.
Відповідь. Для окиснення алюмінію масою 54 г необхідно витратити кисень об'ємом 33,6 л (н. у.) (V(O2) = 33,6 л).
Для розв'язування задачі треба знати формули, що виражають взаємозв'язок між величинами
Виконуючи дії з іменованими числами і використовуючи при цьому будь-які зручні одиниці вимірювання, стеж за тим, у яких одиницях має бути відповідь.
Зверни увагу, майже кожна хімічна задача може бути розв'язана кількома способами. Намагайся знаходити різні варіанти розв'язування конкретної задачі, а обирай той з них, який є найраціональнішим.
Для розв'язування розрахункової задачі використовуй такий алгоритм:
1. Запиши скорочену умову задачі.
2. Склади рівняння хімічної реакції.
3. Підкресли в рівнянні формули речовин, про які йдеться в умові задачі (відомої і невідомої).
4. Над формулами речовин з умови задачі запиши відому величину й невідому з відповідними одиницями вимірювання (йдеться лише про чисті речовини, без домішок).
5. Під формулами речовин з відомою і невідомою величиною запиши відповідні значення цих величин, знайдені за рівнянням реакції.
6. Склади й розв'яжи пропорцію на підставі двох даних, узятих з рівняння реакції, і двох даних — з умови задачі.
7. Запиши повне формулювання відповіді.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Матеріали з хімії за 8 клас, завдання школяру 8 класу, хімія онлайн
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%A0%D0%BE%D0%B7%D1%80%D0%B0%D1%85%D1%83%D0%BD%D0%BA%D0%B8_%D0%B7%D0%B0_%D1%85%D1%96%D0%BC%D1%96%D1%87%D0%BD%D0%B8%D0%BC%D0%B8_%D1%80%D1%96%D0%B2%D0%BD%D1%8F%D0%BD%D0%BD%D1%8F%D0%BC%D0%B8_%D0%BE%D0%B1%D9%B0%D1%94%D0%BC%D1%83_%D1%80%D0%B5%D1%87%D0%BE%D0%B2%D0%B8%D0%BD%D0%B8._%D0%9F%D1%80%D0%B0%D0%BA%D1%82%D0%B8%D0%BA%D1%83%D0%BC%D0%B8,_%D0%BB%D0%B0%D0%B1%D0%BE%D1%80%D0%B0%D1%82%D0%BE%D1%80%D0%BD%D1%96,_%D0%BA%D0%B5%D0%B9%D1%81%D0%B8 практикуми, лабораторні, кейси
] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%A0%D0%BE%D0%B7%D1%80%D0%B0%D1%85%D1%83%D0%BD%D0%BA%D0%B8_%D0%B7%D0%B0_%D1%85%D1%96%D0%BC%D1%96%D1%87%D0%BD%D0%B8%D0%BC%D0%B8_%D1%80%D1%96%D0%B2%D0%BD%D1%8F%D0%BD%D0%BD%D1%8F%D0%BC%D0%B8_%D0%BE%D0%B1%D9%B0%D1%94%D0%BC%D1%83_%D1%80%D0%B5%D1%87%D0%BE%D0%B2%D0%B8%D0%BD%D0%B8._%D0%9F%D1%80%D0%B0%D0%BA%D1%82%D0%B8%D0%BA%D1%83%D0%BC%D0%B8,_%D0%BB%D0%B0%D0%B1%D0%BE%D1%80%D0%B0%D1%82%D0%BE%D1%80%D0%BD%D1%96,_%D0%BA%D0%B5%D0%B9%D1%81%D0%B8 практикуми, лабораторні, кейси
] рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











