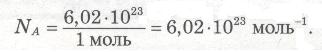|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Кількість речовини. Моль — одиниця кількості речовини. Число Авогадро
Тобі треба
розуміти зміст понять: кількість речовини; моль; число Авогадро;
уміти: здійснювати розрахунки з використанням зазначених понять.
Відомо, що для вивчення навколишнього світу недостатньо лише спостерігати й описувати об'єкти. Важливо ще характеризувати їх кількісно, тобто якимись величинами. Порцію води, наприклад, можна характеризувати кількісно, вимірявши її об'єм у літрах або масу в грамах. Але для хіміка поряд з цим важливо ще знати число структурних частинок (атомів, молекул або йонів), які містяться в цій порції речовини, оскільки саме вони вступатимуть у хімічну взаємодію. Ось чому в хімії і суміжних з нею науках використовують фізичну величину — кількість речовини.
Кількість речовин — це фізична величина, що визначається числом структурних частинок (атомів, молекул, йонів тощо), які містяться в даній порції речовини.
Вона позначається латинською літерою n (ен) або грецькою v (ню), оскільки літерою п (ен) позначається також і число атомів.
За одиницю кількості речовини прийнято моль.
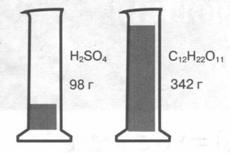
Мал. 1. Один моль різних речовин — сульфатної кислоти і цукру (сахарози)
Кількість речовини можна вимірювати не лише в молях. Одиниця кількості речовини, яка в 1000 разів більша за моль, називається
кіломоль — кмоль (1 кмоль містить 1000 моль), а одиниця кількості речовини, яка в 1000 разів менша за моль, називається мілімоль — ммоль (1 моль містить 1000 ммоль).
Моль — це така кількість речовини, яка містить стільки частинок (атомів, молекул, йонів та ін.), скільки міститься атомів у Карбоні ма-сою 0,012 кг (12 г).
Отже, маса 1 моль вуглецю дорівнює 12 г. А скільки у цій порції вуглецю кількістю речовини 1 моль міститься атомів Карбону?
Експериментально доведено, що 1 моль речовини містить 6,02•1023 (скорочено 6•1023) частинок (атомів, молекул, йонів та ін.). Це число на честь італійського вченого називається числом Авогадро. Зазвичай число Авогадро позначають латинською літерою N з індексом А, тобто NA.

АМЕДЕО АВОГАДРО (1776—1856)
Італійський фізик і хімік. Заклав основи молекулярної теорії, відкрив один із газових законів, названий його ім'ям. Визначив склад і відносну молекулярну масу багатьох речовин. Довів, що молекули водню, кисню, азоту, хлору двоатомні. Його праці сприяли подальшому розвитку атомно-молекулярної теорії
6,02•1023 моль-1 — стала Авогадро NA
Число Авогадро 6,02•1023 показує число частинок, які містяться в 1 моль будь-якої речовини незалежно від її агрегатного стану.
6,02•1023 — це число Авогадро, а фі-зико-хімічна константа, що відповідає цьому числу, називається сталою Авогадро, позначається також NA. Якщо 1 моль речовини містить 6,02•1023 частинок, то:
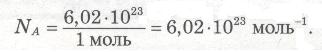
Це настільки велике число, що через силу піддасться уяві. Проте спробуємо показати всю грандіозність цього числа.
Якби ми спромоглися виміряти всю воду Світового океану склянками, то дістали б майже 7 • 1014 склянок. Хоча це число саме по собі величезне, але воно становить лише одну мільярдну частину сталої Авогадро!
Інший приклад. Число макових зерняток, що дорівнює 6•1023, має масу 1013 т. Цією масою макових зерняток можна було б покрити всю поверхню Землі шаром в 1 м. Іще приклад. Пустеля Сахара містить менше трьох моль найдрібніших піщинок.
Отже, 1 моль будь-якої речовини містить NA частинок, тобто 6•1023. Наприклад, 1 моль міді — це 6•1023 атомів Купруму Cu; 1 моль кисню — 6•1023 молекул 02 або 12•1023 атомів Оксигену; 1 моль кухонної солі NaCl — 6•1023 формульних одиниць NaCl.
Розглянемо приклади розрахунків із використанням сталої Авогадро.
Приклад 1. Яке число молекул містить вуглекислий газ кількістю речовини 4 моль?
Розв'язування Дано:
v(C02) = 4 моль
N(C02) — ?
NА = 6•1023 моль-1;
N=NA•v;
N(C02) = 6•1023 моль-1 • 4 моль =24•1023 молекул.
Відповідь. У вуглекислому газі кількістю речовини 4 моль міститься 24•1023 молекул С02.
Приклад 2. Скільки атомів і скільки молекул міститься у хлорі кількістю речовини 3 моль?
Розв'язування: Дано:
v(Cl2) = 3 моль
N(Cl2) —?
n(Сl) — ?
NA = 6•1023 моль-1;
N(Cl2) = 6•1023 моль-1 • 3 моль = 18•1023 молекул.
Оскільки кожна молекула хлору Cl2 містить два атоми, то атомів Хлору в З моль Cl2 буде вдвічі більше, ніж молекул, тобто 18 • 1023 • 2 = 36 • 1023 атомів.
Відповідь. У хлорі кількістю речовини 3 моль міститься 18•1023 молекул Cl2 і 36•1023 атомів Хлору СІ.
ВИСНОВКИ
Кількість речовини — це фізична величина, що визначається числом структурних частинок, які містяться в даній порції речовини.
Моль — це одиниця кількості речовини.
Один моль будь-якої речовини містить 6,02•1023 структурних частинок (формульних одиниць).
Завдання для самоконтролю
1. Скільки атомів Гідрогену й Оксигену міститься у воді Н20 кількістю речовини 1 моль (виконати усно)?
2. Скільки атомів містить: а) мідь кількістю речовини 3 моль; б) залізо кількістю речовини 0,5 моль?
3. Скільки молекул і атомів містить азот N2 кількістю речовини 2 моль?
4. Яку кількість речовини становить: а) З•1023 атомів Сульфуру; б) 18•1023 молекул брому Вr2?
Додаткові завдання
5*. Заповни таблицю:

6*. Число атомів Оксигену в озоні 03 масою 24 г становить
(а) 6•1023; (в) 12•1023;
(б) 3•1023; (г) 18•1023.
7*. У пробірку налили воду об'ємом 18 см3 і закрили корком, але не щільно, а так, щоб щосекунди з неї випаровувався 1 млрд молекул. Скільки часу (годин, днів, років) мине, поки вся вода випариться?
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту.
Хімія скачати, завдання школяру 8 класу, матеріали з хімії для 8 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|