|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Історичні відомості про спроби класифiкації хiмічних елементів. Поняття про лужні, інертні елементи, галогени
СПРОБИ КЛАСИФІКАЦІЇ ХІМІЧНИХ ЕЛЕМЕНТІВ
Тобі треба
мати уявлення: про перші спроби класифікації хімічних елементів.
Відомо, що розвиток будь-якої науки проходить етапи нагромадження і вивчення фактів, їх класифікації і виявлення зв'язків між фактами, встановлення певних закономірностей. Так само і в хімії. Окремі хімічні елементи були відомі за давніх-давен, коли хімії як науки ще не було. Проте наприкінці XVIII і особливо в XIX ст. число елементів почало стрімко збільшуватися. До середини XIX ст. вже було відомо 63 хімічні елементи, які утворювали сотні тисяч хімічних сполук. Нагромадження знань про хімічні елементи та їхні сполуки спричинило необхідність привести цю багатоманітність у певну систему.
Поняття «система» у перекладі з грецької означає «ціле, складене з частин». Система відрізняється від простої суми частин тим, що в ній між частинами встановлюються взаємозв'язки і залежності. В системі знань про хімічні елементи також необхідно встановити залежність, природні зв'язки між відомими на той час елементами.
Одну з перших спроб класифікації хімічних елементів здійснив у 1804 р. шведський хімік Я. Берцеліус. Він поділив усі відомі тоді 32 елементи на дві групи — метали і неметали за відмінністю властивостей простих речовин. Але ця класифікація виявилася непридатною, оскільки вона не враховувала властивості перехідних металів, які утворюють амфотерні оксиди і гідроксиди, а тому посідають проміжне місце між металами і неметалами.
Пошуки тривали. Хіміки брали за основу класифікації хімічних елементів подібність властивостей простих і складних речовин, які вони утворюють. Так були виокремлені кілька родин подібних хімічних елементів.
ВИСНОВКИ
Першою класифікацією хімічних елементів був їх поділ на метали і неметали. Виявлення природних груп подібних за властивостями елементів стало дальшим кроком на шляху розвитку їх класифікації.
ПОНЯТТЯ ПРО ЛУЖНІ МЕТАЛИ
Тобі треба
знати: фізичні й хімічні властивості лужних металів;
уміти: складати рівняння відповідних реакцій; пояснювати характер змінення властивостей лужних металів залежно від відносної атомної маси відповідних елементів.
До родини лужних металів належать елементи: Літій Li, Натрій Na, Калій К, Рубідій Rb, Цезій Cs і Францій Fr (радіоактивний елемент).
Пригадай, що згідно з новою українською термінологією назви хімічних елементів пишуться з великої літери, а назви простих речовин, утворених цими елементами, — з малої.
• Знайди лужні метали за періодичною системою хімічних елементів.
Усі лужні метали в сполуках виявля ють валентність 1. Утворені ними прості речовини — метали. Вони мають одна кову кристалічну структуру, металіч ний блиск, м'які (легко ріжуться ножем), пластичні, легкоплавкі. Мають невелику густину (легші за воду). Добре проводять електричний струм і теплоту.
У хімічному відношенні порівняно з рештою металів лужним металам власти ва висока хімічна активність. Так, якщо розрізати ножем кусок натрію або калію, то на свіжому зрізі він матиме яскравий металічний блиск, який одразу ж, практично миттєво, тьмянішає через окиснен-ня киснем повітря.
• Напиши рівняння реакції окиснення літію киснем повітря.
Тому й зберігають літій, натрій, калій у посудинах під шаром гасу, а рубідій і цезій — у запаяних ампулах, з яких видалено повітря.
Висока хімічна активність лужних металів виявляється й під час взаємодії їх з водою.
Лужні метали — найактивніші метали
Під час повільного окиснення натрію або горіння в умовах нестачі кисню утворюється оксид:
4Na + O2 = 2Na2O
Чи знаєш ти, що калій навіть займається, коли на нього потрапляє волога? Його гасять кухонною сіллю NaCI чи содою Na2CO3
Дослід 1. У склянку з водою опускаємо кусочок натрію (мал. 7). Він одразу ж спливе на її поверхню (чому?) і розплавиться, бо при цьому виділяється теплота. Блискуча крапля натрію швидко рухається по поверхні води, шипить і зменшується в розмірі, доки не щезне. Крапля рухається, бо її штовхає газ, що виділяється при цьому. Аби дізнатися, який це газ, зберемо його в пробірку і піднесемо до полум'я. Чутно характерний приглушений звук «п-пах», властивий горінню чистого водню. Якщо водень не чистий (змішаний з повітрям) — різкий «гавкаючий» звук. Отже, в результаті взаємодії натрію з водою виділяється водень Н2 й утворюється луг NaOH:
2Na + 2Н2O = 2NaOH + Н2↑
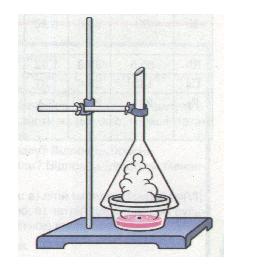
Мал. 7. Взаємодія натрію з водою
Наявність лугу NaOH можна виявити, якщо до розчину додати 1—2 краплі фенолфталеїну або на предметне скло помістити 1—2 краплі розчину і випарити з нього воду. Залишається тверда біла речовина — натрій гідроксид NaOH (їдкий натр).
Лужні метали енергійно реагують також з хлором Сl2, сіркою S та іншими неметалами.
• Знаючи валентність Хлору 1, а Сульфуру 2, напиши відповідні рівняння реакцій.
Деякі властивості лужних металів наведено в табл. 9.
• Різна хімічна активність лужних металів відносно кисню та води пов'язана зі зміною відносної атомної маси: чим вона більша, тим більша активність лужного металу.
Таблиця 9. Властивості лужних металів
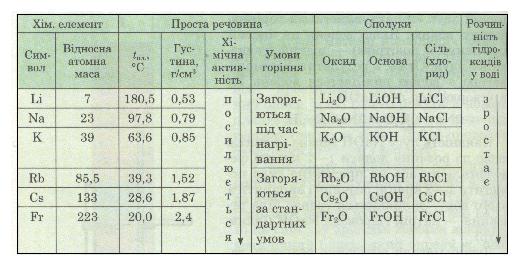
З таблиці видно, що властивості простих і складних речовин закономірно змінюються в міру збільшення відносних атомних мас елементів. Так, температура плавлення лужних металів у ряду літій — францій знижується, а густина — збільшується.
ВИСНОВКИ
Лужні метали — одна з природних родин подібних за властивостями елементів. Усі вони утворюють: а) прості речовини — типові метали, які мають подібні фізичні й хімічні властивості, й б) основні оксиди складу R2O та відповідні їм гідроксиди — луги складу ROH.
Зі збільшенням відносної атомної маси лужних металів температура плавлення простих речовин (лужних металів, утворених цими елементами) знижується, а густина зростає. Лужні метали за стандартних умов активно взаємодіють з водою, киснем повітря та іншими неметалами. Різна хімічна активність відносно кисню та води також зв'язана зі зміною відносної атомної маси: чим вона більша, тим більша активність лужного металу.
Відмінність між лужними металами проявляється в тім, що спільні для них властивості у різних металів виражені різною мірою: зі збільшенням відносної атомної маси закономірно змінюються їх фізичні властивості, збільшується хімічна активність відносно кисню й води.
Завдання для самоконтролю
1. Назви елементи, які утворюють родину лужних металів, і, користуючись даними, що наведені в табл. 9, порівняй їх фізичні властивості.
2. Який із лужних металів можна розплавити, тримаючи в руці запаяну ампулу з цим металом? Чому його не можна просто покласти на долоню, як інші метали, наприклад залізо або мідь? Відповідь поясни.
3. Як ти думаєш, чому лужні метали мають таку назву? Відповідь поясни.
4. Які спільні хімічні властивості мають лужні метали? Відповідь ілюструй рівняннями реакцій.
5. Напиши рівняння реакцій, що відбуваються між: а) літій оксидом і сульфур(VІ) оксидом; б) літій оксидом і хлоридною кислотою; в) натрій гідроксидом і сульфатною кислотою; г) рубідій гідроксидом і нітратною кислотою.
Додаткові завдання
6. Напиши рівняння реакцій між: а) калієм і хлором; б) цезієм і сіркою; в) рубідієм і водою; г) цезій оксидом і водою; д) калій гідроксидом і ортофосфатною кислотою.
7. Якими двома способами можна добути натрій гідроксид? Напиши рівняння відповідних реакцій.
8*. Одновалентний метал масою 17 г спалили в кисні об'ємом 1,12 л (н. у.). Назви метал, який було спалено.
9*. На нейтралізацію нітратної кислоти масою 25,2 г витрачено гідроксид лужного металу масою точно 22,4 г. Напиши формулу цього гідроксиду і зазнач його назву.
10*. Дано схему генетичного ряду елемента R: R → RO → R(OH)2 → RCl2. Визнач, до якої родини належить цей елемент і напиши відповідні рівняння реакцій.
11*. На лужний метал масою 3,5 г подіяли водою. При цьому виділився водень об'ємом 5,6 л (н. у.). Який лужний метал прореагував з водою?
ПОНЯТТЯ ПРО ГАЛОГЕНИ
Тобі треба
знати: фізичні й хімічні властивості галогенів;
уміти: складати рівняння відповідних реакцій; пояснювати характер змінення властивостей галогенів залежно від відносної атомної маси хімічних елементів.
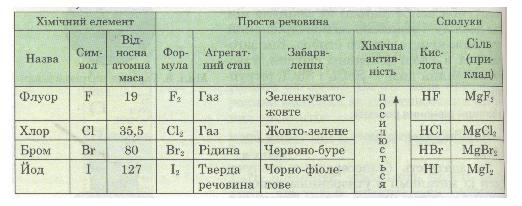
До галогенів належать Флуор F, Хлор СІ, Бром Вr, Йод І і Астат At (радіоактивний елемент). Це ще одна природна родина подібних за властивостями хімічних елементів.
Галогени — найактивніші неметали
Ці елементи утворюють прості речовини, які також називаються галогенами. Вони являють собою типові неметали. За стандартних умов фтор F2 — газ, хлор Сl2 — газ, бром Вr2 — рідина, йод І2 — легкоплавка кристалічна речовина (*пл. = 113,5 °С).
Галогенам властива леткість і надзвичайно висока хімічна активність. Вони вступають у взаємодію майже з усіма простими речовинами. Особливо швидко і з виділенням великої кількості теплоти відбувається сполучення галогенів із металами.
Дослід 1(у витяжній шафі). У колбу, заповнену хлором, вносимо металічну ложку для спалювання речовин з розплавленим натрієм. В атмосфері хлору натрій згоряє зі сліпучим спалахом, а на стінках циліндра з'являється білий наліт натрій хлориду:
2Na + Cl2 = 2NaCl
Мідь, залізо та багато інших металів згоряють у хлорі, утворюючи відповідні солі.
Дослід 2 (у витяжній шафі). На дно великої колби або банки насипаємо шар піску, аби колба (банка) не лопнула під час досліду, і всипаємо свіжоподрібнений порошок кристалічного стибію. Він загоряється в хлорі яскравим світлом, утворюючи білий дим — SbCl5 і SbCl3 (отруйні).
• Напиши рівняння реакцій.
Подібно взаємодіють з металами бром і йод.
За здатність безпосередньо сполучатись із металами з утворенням типових солей елементи Флуор, Хлор, Бром, Йод називають галогенами, що з грецької буквально означає «солеродні» (ті, що народжують солі).
Галогени взаємодіють з багатьма неметалами, у тім числі з воднем. Так, фтор F2 у суміші з воднем вибухає навіть у темряві й на холоді, хлор Сl2 з воднем вибухає на яскравому світлі або під час нагрівання (за стандартних умов без освітлення хлор практично не взаємодіє з воднем). Бром Вr2 взаємодіє з воднем менш енергійно і лише під час нагрівання. Йод реагує з воднем лише при досить сильному нагріванні і не повністю, оскільки утворений йодоводень НІ — нестійка сполука:
Н2 + F2 = 2HF Н2 + Вr2 = 2НВr
Н2 + Сl2 = 2НСl Н2 + І2 = 2НІ

Мал. 8. Горіння натрію в хлорі

Мал. 9. Горіння стибію в хлорі
Галогени — хімічно активні елементи, тому в природі вони трапляються лише у складі сполук, виявляючи валентність 1. Приклади природних сполук галогенів: Флуору — плавиковий шпат CaF2; Хлору — кам'яна (кухонна) сіль NaCI; сполуки Брому та Йоду є у воді бурових свердловин, у воді морів та деяких озер, а також у морських водоростях
Хоча активність галогенів при цьому різна, та склад продуктів реакції однаковий: утворюються газуваті сполуки — галогеноводні HF, НСl, НВг, НІ, водні розчини яких є кислотами. Деякі властивості галогенів подано в табл. 10.
Таблиця 10. Властивості галогенів
Учені поступово дізналися й про інші групи елементів, що мають подібні властивості. Так, одну групу подібних елементів склали Нітроген, Фосфор, Арсен, Стибій, Вісмут, іншу — Оксиген, Сульфур, Селен, Телур (див. періодичну систему хімічних елементів).
Виявлення природних груп подібних за властивостями елементів стало важливим етапом на шляху розвитку класифікації хімічних елементів. Якщо першою класифікацією був поділ елементів на металічні й неметалічні (на основі протилежних властивостей їх простих речовин — металів і неметалів), то далі було виявлено природні групи, всередині яких спостерігався взаємозв'язок між елементами. Проте такі групи елементів розглядалися відособлено. Загального
зв'язку між елементами ще не виявили. Адже було важко припустити, що між елементами, протилежними за властивостями, наприклад між лужними металами і галогенами, існує взаємозв'язок.
Але спроби робилися. Багато вчених намагалося розібратись у величезній кількості фактів. Так, у 1864 р. німецький хімік Лотар Мейєр опублікував таблицю, в якій йому вдалося із 63 відомих на той час елементів розмістити 27 за зростанням їх відносних атомних мас. Усі відомі елементи Лотар Мейєр не зміг включити у цю таблицю, оскільки для більшості з них ще не були визначені відносні атомні маси.

Юліус Лотар Мейєр (1830—1895)
Німецький хімік. Склав таблицю (1864) 27 хімічних елементів, розміщених за зростанням атомних мас і валентністю, але не зробив теоретичних узагальнень. Слідом за Менделєєвим (1870) склав повну таблицю хімічних елементів. Побудував криві атомних об'ємів елементів
Історія розвитку хімії показала, що Лотар Мейєр був на правильному шляху у своїх спробах класифікувати елементи. Адже він за основу брав єдину на той час загальну для всіх хімічних елементів фізичну величину — масу. Проте відкрити закон, який об'єднує всі елементи у струнку систему, вдалося у 1869 р. великому російському вченому, професору Петербурзького університету Д. І. Менделєєву.
ВИСНОВКИ
Галогени — природна родина елементів, що являють собою типові неметали. Зі збільшенням відносної атомної маси цих елементів темнішає їх забарвлення й закономірно змінюється агрегатний стан від газуватої до твердої речовини. Галогени активно взаємодіють з металами, утворюючи солі. Вони реагують з воднем, утворюючи газуваті галогеноводні, водні розчини яких є кислотами. Зі збільшенням відносної атомної маси хімічна активність галогенів послаблюється. Галогени за властивостями протилежні лужним металам: якщо галогени — типові неметали, то лужні метали — типові метали.
Багато спроб класифікації елементів зробили різні вчені, а успіху досяг великий російський учений Д. І. Менделєєв, якому вдалося об'єднати всі елементи (подібні й відмінні за властивостями) в єдину систему хімічних елементів.
Завдання для самоконтролю
1. За якими ознаками хімічні елементи об'єднані: а) в родину лужних металів; б) у родину галогенів?
2. Напиши рівняння реакцій, що ілюструють хімічні властивості галогенів.
3. Які властивості галогенів засвідчують, що вони є типовими неметалами? Напиши рівняння реакцій.
4. За якими ознаками галогени відрізняються: а) один від одного; б) від лужних металів? Відповідь мотивуй.
5. Схарактеризуй хімічні властивості брому. Сформулюй закономірність зміни властивостей галогенів зі збільшенням відносної атомної маси.
6. Визнач, до якої родини належить хімічний елемент, якщо формула його оксиду R20. Напиши рівняння реакцій, які ілюструють хімічні властивості цього оксиду.
7. Якщо розчинити у воді лужний метал кількістю речовини 1 моль, то можна дістати водень об'ємом (н. у.)
(а) 5,6 л; (б) 11,2 л; (в) 22,4 л; (г) 44,8 л.
Додаткові завдання
8. В одну з природних груп елементів були об'єднані Кальцій, Стронцій та Барій, які дістали назву лужноземельних металів. Знайди їх у періодичній системі хімічних елементів, напиши формули їх оксидів та гідроксидів і зазнач назви цих сполук.
9*. Вищий оксид хімічного елемента має склад RO. Визнач валентність елемента в цій сполуці. Напиши формулу гідроксиду, що відповідає даному оксиду, і передбач його властивості. Напиши рівняння хімічних реакцій, що підтверджують передбачені властивості.
10. Чи вистачить 2 л хлору (н. у.), аби добути стибій(\/) хлорид унаслідок спалювання стибію масою 5 г?
11. Кількість речовини алюміній броміду, що утворюється внаслідок взаємодії алюмінію з бромом масою 12 г, становить
(а) 1 моль; (б) 0,1 моль; (в) 0,01 моль; (г) 0,05 моль.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Програма з хімії за 8 клас, реферати та конспекти уроків з хімії, виконуємо домашнє завдання онлайн
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
















