|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Будова атома: ядро і електронна оболонка. Склад атомних ядер (протони і нейтрони). Протонне число. Нуклонне число. Сучасне формулювання періодичного закону
БУДОВА АТОМА. ФІЗИЧНИЙ ЗМІСТ ПЕРІОДИЧНОГО ЗАКОНУ
Тобі треба
мати уявлення: про радіоактивність;
знати: сучасне формулювання періодичного закону; будову атома;
уміти: визначати протонне число атома елемента
Тобі вже відомо, що Д. І. Менделєєв узагальнив великий обсяг знань і відкрив фундаментальний закон природи — періодичний закон. Але рівень тогочасних знань не давав змоги розкрити фізичний зміст періодичного закону, виявити причини періодичної зміни властивостей елементів залежно від зростання їх атомних мас. Це стало можливим лише після з'ясування будови атома.
У науці довго панувала думка, що атоми — найменші частинки речовини і не містять інших, простіших складових частинок. Тому вони неподільні і не можуть перетворюватися на інші атоми. Проте наприкінці XIX ст. фізики експериментально підтвердили складність будови атома. Відкриття рентгенівських променів (1895), явища радіоактивності (1896), електрона (1897) спричинили революцію в природознавстві, зокрема сприяли перегляду уявлень про структуру і властивості речовини, оскільки атом виявився складним утворенням. Саме відкриття радіоактивності відіграло велику роль у встановленні складної природи атома і розкритті його структури.

Антуан Анрі Беккерель (1852—1908)
Французький фізик, член Паризької Академії наук (з 1889). Його наукові праці присвячені фотохімії, електрохімії, магнетизму, оптиці, електриці, метеорології. Відкрив разом із подружжям Марії і П'єра Кюрі природну радіоактивність солей Урану, за що був удостоєний Нобелівської премії (1903)
Поняття про радіоактивність. Досліджуючи солі Урану, французький фізик А. Беккерель виявив, що елемент Уран випромінює невидимі для окаліро-мені, подібні до рентгенівських. Його дослідами зацікавилися інші вчені. Зокрема, Марія Склодовська-Кюрі встановила, що сполуки Торію Th також мають цю здатність. Разом зі своїм чоловіком, французьким фізиком ІГєром Кюрі, вона відкрила два нові елементи, названі за її пропозицією Полонієм Ро (від лат. Роїо-піа — Польща) і Радієм Ra (від лат. radius — промінь), які виявилися значно потужнішими джерелами випромінювання, ніж Уран і Торій. Таку здатність деяких елементів назвали радіоактивністю, а елементи — радіоактивними.
Вивчаючи природу радіоактивного випромінювання, англійський фізик Ернест Резерфорд установив, що воно неоднорідне: під дією електричного поля поділяється на три пучки, один з яких не змінює свого початкового напрямку, отже, не несе електричного заряду, — це у-ви-промінювання (електромагнітні хвилі), а два інші — відхиляються у протилежні боки до зарядів електричного поля (мал. 10). Це а-проміння (ядра атомів елемента Гелію) і (3-проміння (потік електронів).
Вчення про радіоактивність підтвердило складність будови атома.
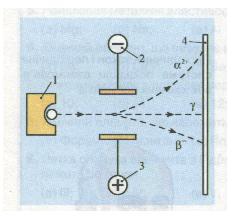
Мал. 10. Дія електричного поля на радіоактивне випромінювання: 1 — джерело випромінювання у свинцевому контейнері; 2 — катод; 3 — анод; 4 — екран для реєстрування випромінювання (вкритий речовиною, що може світитися під впливом якогось джерела енергії)
Будова атома. Вивчаючи розсіювання а-частинок, які проходять крізь тонкі металеві пластинки, Е. Резерфорд у 1911 р. запропонував схему будови атома, що дістала назву ядерна модель атома. Згідно з цією моделлю атом складається з позитивно зарядженого ядра і негативно заряджених електронів, що обертаються
навколо нього. Позитивний заряд ядра нейтралізується сумарним негативним зарядом електронів, так що атом загалом електронейтральний.

Марія Склодовська-Кюрі (1867—1934)
Польська і французька вчена — фізик і хімік, одна з творців учення про радіоактивність. Виявила радіоактивність Торію. Разом із Пером Кюрі відкрила Полоній і Радій. Запропонувала термін «радіоактивність». Добула металічний радій (1910) і дослідила його властивості. Лауреат Нобелівської премії з фізики (1903) разом із П. Кюрі та А. Бек-керелем. Лауреат Нобелівської премії з хімії (1911)
Порядковий номер елемента — заряд ядра його атома. Численні експериментальні дослідження англійських учених (Е. Резерфорда, Г. Мозлі, 1917 р.) показали, що заряд ядра атома дорівнює порядковому номеру елемента в періодичній системі.
Так було розкрито фізичний зміст порядкового номера. Він виявився дуже важливою константою, що виражає величину заряду ядра. Оскільки атом загалом електронейтральний, то й число електронів у атомі також дорівнює порядковому номеру елемента. Наприклад, порядковий номер елемента Феруму Fe — 26. Це означає, що заряд ядра його атома +26, а оскільки атом електронейтральний, то й електронів повинно бути 26, сумарний негативний заряд яких становить -26 (заряд електрона — найменший негативний заряд, прийнятий за одиницю).
Відкриття фізичного змісту порядкового номера дало нове обґрунтування розміщенню елементів у періодичній системі. З'ясувалося, що елементи розміщені не стільки за зростанням атомної маси, скільки за зростанням заряду ядер їх атомів. Дістала пояснення й удавана суперечність у системі Д. І. Менделєєва — розміщення трьох пар елементів (Аргон і Калій, Кобальт і Нікол, Телур і Йод) не в порядку зростання їх атомних мас, а навпаки. Виявилось, що таке розміщення відповідає величині зарядів ядер атомів цих елементів. Отже, суперечності немає.

Ернест Резерфорд (1871—1937)
Англійський фізик, член Лондонського королівського товариства (з 1903), один із творців учення про радіоактивність і будову атома. Відкрив а- і (5-промені та визначив їхню природу (1899). Вперше експериментально виявив перетворення нераді-оактивних елементів (Нітрогену в Оксиген) внаслідок опромінювання а-частинками. Запропонував ядерну модель будови атома (1911). Здійснив першу штучну ядерну реакцію (1919). Передбачив існування нейтрона. Лауреат Нобелівської премії (1908)
На основі відкриття фізичного значення порядкового номера періодичний закон Д. І. Менделєєва нині формулюється так:
властивості елементів і утворених ними простих і складних речовин перебувають у періодичній залежності від величини заряду ядер їх атомів.
Уточнення формулювання періодичного закону — необхідний наслідок дальшого розвитку пізнання. Періодичний закон — це об'єктивний закон природи. Він реально існує і діє незалежно від людської свідомості, а його формулювання відображає рівень розуміння людством цього закону. З часом формулювання законів (як і понять) може змінюватись, якщо нові відкриття дають змогу глибше зрозуміти їхню суть. Саме так відбулось і з періодичним законом, через що виникла необхідність уточнити його формулювання. Приклад із формулюванням періодичного закону дає тобі змогу зрозуміти закономірності процесу пізнання: від вивчення й узагальнення фактів — до виявлення закону природи і далі до пояснення цього закону на основі нових фактів.
ВИСНОВКИ
Наукові відкриття наприкінці XIX ст. — відкриття рентгенівських променів, радіоактивності, електрона — сприяли перегляду поглядів на атом як найпростішу, найменшу частинку речовини.
Атом — складне утворення. Він складається з позитивно зарядженого ядра і негативно заряджених електронів. Величина заряду ядра атома дорівнює порядковому номеру елемента в періодичній системі.
Елементи в періодичній системі розміщені за зростанням величини заряду ядер їх атомів.
Властивості елементів та їх сполук перебувають у періодичній залежності від величини заряду ядер їх атомів.
Завдання для самоконтролю
1. У чому полягає суть радіоактивності? Хто і як відкрив це явище? Назви два-три радіоактивні елементи.
2. Що являє собою атом? Хто вперше запропонував модель атома?
3. У чому полягає фізичний зміст порядкового номера елемента?
4. Визнач заряд ядра атомів Нітрогену, Неону, Магнію, Сульфуру і число електронів у атомах цих елементів.
5. Наведи сучасне формулювання періодичного закону і порівняй його з менделєєвським (див. § 20). Як ти думаєш, чи принижує велич менделє-євського відкриття зміна з часом формулювання відкритого ним закону? Відповідь обґрунтуй.
СКЛАД АТОМНИХ ЯДЕР. ІЗОТОПИ
Тобі треба
мати уявлення: про стабільні й радіоактивні ізотопи; радіаційну безпеку;
розуміти зміст і вміти користуватися поняттями: протон, протонне число; нейтрон; нуклон-не число; нуклід; ізотопи;
уміти визначати: число нейтронів у ядрі певного нукліда.
Ти вже знаєш, що атом складається з ядра й електронів. У свою чергу, ядро атома, згідно з сучасними уявленнями, складається з протонів і нейтронів, загальна назва яких нуклони (від лат, nucleus — ядро).
Що собою являють оці субатомні частинки? Аби відповісти на це запитання, розглянь табл. 12.
Таблиця 12. Характеристика субатомних частинок
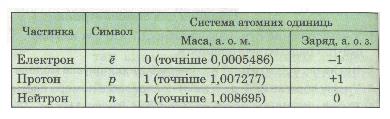
Виявляється, протон (символ р) мас заряд +1, а нейтрон (символ n) заряду не має (електронейтральний). Число протонів у ядрі атома дорівнює порядковому номеру елемента і визначає його місце у періодичній системі. Тому порядковий номер елемента називають протонним числом. Отже,
протонне число (порядковий номер) дорівнює величині заряду ядра атома елемента.
Маса протона майже така сама, як і маса нейтрона, і становить одну атомну одиницю маси (а. о. м.), що в 1836 разів більше за масу електрона. Це означає, що практично вся маса атома зосереджена в його ядрі.
Масca атома та його розміри надзвичайно малі. Ще менше ядро атома. Воно у 10—100 тисяч разів менше за атом. Якби атом можна було збільшити до розмірів Землі, то його ядро мало б радіус лише 30—60 м.
Як же утримуються протони й нейтрони в ядрі? Адже всі протони — позитивно заряджені, а нейтрони — електронейтральні. Чому ж ядро не розсипається на окремі частинки? Протони і нейтрони утримуються в ядрі специфічними ядерними силами. Ці сили діють лише на дуже малих відстанях (не більше 10~13 см) і досягають надзвичайної величини, яка в 100—1000 разів перевищує кулонівське відштовхування однойменно заряджених протонів. Природа ядерних сил остаточно ще не з'ясована.
А як можна визначити склад атомних ядер? Ти знаєш, що протонне число (порядковий номер) елемента відповідає величині заряду ядра його атома, тобто числу протонів. І знаєш відносну атомну масу елемента, яка дорівнює переважно сумі протонів і нейтронів, тому легко обчислити число нейтронів у ядрі. Наприт клад, протонне число елемента Калію дорівнює 19. Це означає, що заряд ядра його атома +19, тобто в ядрі міститься 19 протонів. Оскільки відносна атомна маса Калію — 39, то в ядрі його атома міститься 39 - 19 = 20 нейтронів.
Кожний вид атомів, незалежно від того, якому елементу він належить, однозначно описується сумою протонів і нейтронів — нуклонним числом. Саме тому видів атомів більше, ніж елементів. Кожний окремий вид атомів (вид ядра) називається нуклідом.
Нукліди — це різновиди атомів (атомних ядер) з певним числом протонів і нейтронів.

Термін «нуклід» вживається для позначення будь-яких атомів, що відрізняються складом ядра (або різним числом нуклонів, або при однаковому числі нуклонів різним співвідношенням протонів і нейтронів).
Для позначення нукліда використовують або назву елемента, до якої через дефіс приєднують нуклонне число (Окси-ген-16), або символ елемента, зверху ліворуч від якого також зазначають нуклонне число (160).
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами (від гр. ізос — однаковий і топос — місце).
Ізотопи — це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра).
Позначення нуклідів Оксигену:
Оксиген-16, Оксиген-17, Оксиген-18 або 16О, 17О,18О
Зверни увагу, термін «ізотопи» вживається лише у множині (застаріле «ізотоп» і є нуклід). Наприклад, природний Оксиген, крім нуклідів 16О, містить ще атоми з нуклонними числами 17 і 18. Це означає, що в природному Оксигені є різні види атомів, які в ядрі містять однакову кількість протонів (по 8), але різну кількість нейтронів (відповідно 8, 9, 10). Саме тому вони й різняться між собою атомною масою. Зазначені нукліди 16О, 17О,18О і є ізотопами Оксигену.
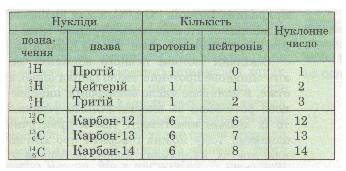
Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Виняток становлять лише ізотопи найлегшого з елементів — Гідрогену. Вони мають нуклонні числа 1, 2, 3 і власні назви та символи (табл. 13).
Таблиця 13. Ізотопи Гідрогену й Карбону
Відкриття ізотопів дало змогу поглибити знання про хімічний елемент як вид атомів, що характеризується однаковим протонним числом (зарядом ядра).
Звичайно в природі більшість хімічних елементів існує у вигляді ізотопів. Тому відносна атомна маса таких елементів визначається величинами відносних атомних мас кожного з нуклідів з урахуванням їх масової частки в природі. Наприклад, елемент Оксиген являє собою суміш ізотопів — нуклідів 16О 99,757 %, 17О 0,039 % і 18О 0,204 %. Аби знайти відносну атомну масу Оксигену, треба:

Заокруглюємо знайдене середнє значення, виходить Аr(0) = 16.
Відносна атомна маса елемента в періодичній системі — це середнє значення атомних мас його ізотопів з урахуванням їх масових часток у природному елементі
Саме тому, що майже всі елементи — це суміші нуклідів, їх відносні атомні маси не цілочислові, а дробові.
Але ти можеш заперечити, чому ж тоді відносна атомна маса таких елементів як Натрій, Алюміній, Фосфор, Флуор, які не мають ізотопів, не є цілочисловою, а лише наближається до неї? Це пояснюється тим, що Карбон, який береться за точку відліку атомних мас інших елементів, сам складається з двох природних ізотопів 12С і 13С, а для визначення відносної атомної маси береться один із природних ізотопів, саме 12С, або Карбон-12.
Оскільки ізотопи певного елемента мають однакове протонне число (заряд ядра), а отже, й однакове число електронів, які однаково розміщені за енергетичними рівнями, то їх хімічні властивості також практично однакові. Тому можна говорити про хімічні властивості, наприклад Хлору, не беручи до уваги його ізотопний склад.
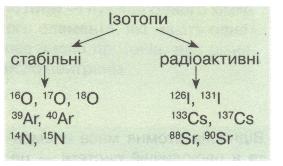
Ізотопи (окремі нукліди) поділяють на стабільні і радіоактивні (радіонукліди). Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом (зарядом ядра) < 83. Нукліди всіх елементів, розміщених у періодичній системі після Вісмуту, радіоактивні.
Радіоактивний розпад хімічних елементів. У процесі радіоактивного випромінювання атоми радіоактивних елементів розпадаються, перетворюючись на атоми інших елементів. Так, кожен атом Радію Ra розщеплюється на атом Гелію Не та атом Радону Rn. Відповідні прості речовини — гелій і радон — належать до родини інертних газів:
22688Ra → 42He + 22286Rn
Радон також радіоактивний. Він випромінює електрон і перетворюється на нуклід Францію-222 і т. д.:
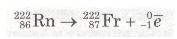
На відміну від хімічних реакцій, під час яких атоми залишаються незмінними, у наведених рівняннях процесів радіоактивного розпаду відбувається перетворення одних атомів на інші. Такі процеси належать до ядерних реакцій.
Кожний радіонуклід має свою швидкість радіоактивного розпаду, яку неможливо ні збільшити, ні зменшити. Ця швидкість не залежить від конкретних чинників і характеризується періодом піврозпаду. Він показує, що протягом деякого часу розпадається половина первинної кількості наявного радіонукліда. В наступний такий самий інтервал часу розпадається половина залишку, тобто вдвічі менше, ще в наступний — ще вдвічі менше, ніж у попередній, і т. д. Спостерігаючи, наприклад, за зміною кількості Радону-222, встановили, що через 3,85 доби залишається половина його початкової кількості, ще через 3,85 доби — тільки 1/4, потім 1/8 і т. д.
Інтервал часу, протягом якого кількість радіоактивних атомів даного елемента зменшується вдвічі, називають періодом піврозпаду.
Ця величина характеризує тривалість життя елемента. Для різних радіоактивних елементів вона коливається від часток секунди до мільярдів років. Так, для Полонію 218Ро період піврозпаду становить 3 хв, для Радію 226Ra — 1620 років, для Урану 238U — 4,5 млрд років, що можна порівняти з віком Землі, а для Торію 232Th — втричі більше — 14 млрд років. Зрозуміло, що аварія на Чорнобильській АЕС (1986 p.), унаслідок якої на Україну (та інші країни) «звалилася» майже вся таблиця Менделєєва з багатьма радіоактивними елементами, завдала непоправної шкоди передусім нашому народу.

Радіоактивне випромінювання (радіація) небезпечне тим, що воно невидиме, не має ні запаху, ні смаку, тому людина його ніяк не відчуває. Проте воно, особливо упромені, має велику проникну здатність. Проникаючи всередину живих організмів, радіація викликає йонізацію молекул біологічної системи, руйнує клітинні мембрани, вражає клітини кісткового мозку тощо. А це призводить до генетичних ушкоджень, які передаються у спадок майбутнім поколінням клітин, якщо клітини не встигли загинути. У свою чергу, це призводить до порушень імунної системи, зниження опірності живого організму різним захворюванням тощо.
До недавнього часу вважалося, що існує безпечний рівень, нижче за який радіація не впливає на здоров'я людини. Нині такий погляд спростовано. Тривалий вплив малих доз радіації чинить руйнівну дію на живі організми. Багато які захворювання, що раніше ніколи не пов'язувалися з рівнем радіації (грип, пневмонія, діабет, хвороби серця і нирок, параліч), насправді суттєво залежать навіть від малих доз опромінення, в тім числі й внутрішнього, що спричинюється потраплянням радіонуклідів всередину організму разом із питною водою і продуктами харчування.
Зменшити вплив радіації на здоров'я людини можна, якщо вживати таких заходів: не споживати забруднені радіонуклідами продукти харчування і питну воду; якомога частіше вживати такі продукти, які містять пектини (яблука, лимони, особливо їхня шкірка), що здатні «виводити радіацію»; вживати сорбенти — речовини, здатні вбирати і виводити з організму радіонукліди; боротися з пилом: регулярно чистити одяг, взуття, мити підлогу, бо пил може містити радіоактивні елементи.
Після відкриття явища радіоактивного розпаду стало зрозуміло, що хімічні елементи не є вічними і незмінними. Вони можуть перетворюватися один на одний. Цей факт засвідчує взаємозв'язок усіх елементів, їх спорідненість.
Чи знаєш ти, що на відміну від м'яса сало не забруднюється радіонуклідами? Тому в Англії, коли вирощують свиней для одержання бекону, час від часу контролюють товщину шарів сала та м'яса, згодовуючи тваринам короткожи-вучі радіонукліди та вимірюючи радіоактивність м'яса тварин
ВИСНОВКИ
Ядра атомів мають складну будову. Вони складаються з двох видів частинок — протонів і нейтронів, що утримуються ядерними силами. Протон р — позитивно заряджена частинка із зарядом +1 і масою, яка практично дорівнює 1, тому ядра атомів заряджені позитивно. Величина їх заряду чисельно дорівнює кількості протонів — протонному числу.
Нейтрон n — електронейтральна частинка, маса якої також практично дорівнює 1.
Маса атома визначається масою його ядра. Загальне число протонів і нейтронів — нуклонне число — обумовлює масу атома. Кількість нейтронів у ядрі чисельно дорівнює різниці між масою атома і масою протонів.
Загальна назва атомів (атомних ядер) з певним значенням нуклонно-го числа — нукліди.
Ізотопи — це нукліди одного хімічного елемента. Вони мають однакове число протонів, але різне число нейтронів. У періодичній системі ізотопи займають одне й те саме місце.
Нукліди бувають стабільні та радіоактивні. Останні самочинно розпадаються, що супроводжується випромінюванням — радіацією, яка шкідливо впливає на все живе.
Завдання для самоконтролю
1. Чому протонне число є важливою константою хімічного елемента? Відповідь обґрунтуй.
2. Протонне число елемента дорівнює загальному числу
(а) нейтронів; (в) нейтронів і протонів;
(б) протонів; (г) протонів і електронів.
3. Основний внесок у масу атома роблять
(а) протони й електрони; (в) протони й нейтрони;
(б) ядро; (г) нейтрони й електрони.
4. Загальне число електронів у атомі елемента з протонним числом 13 і відносною атомною масою 27 —
(а) 13; (б) 14; (в) 27; (г) 40.
5. Число протонів у нукліді Фосфору —
(а) 15; (б) 17; (в) 31; (г) 46.
6. Число нейтронів у нукліді Урану —
(а) 235; (б)92; (в) 327; (г) 146.
7. Ядро атома одного з ізотопів Купруму містить 36 нейтронів. Нуклонне число цього нукліда дорівнює
(а) 96; (б) 29; (в) 65; (г) 94.
Додаткові завдання
8. Що таке хімічний елемент? Як пояснити існування дробових значень відносних атомних мас елементів у періодичній системі?
9*. У молекулі нітроген(ІІ) оксиду число протонів дорівнює
(а) 30; (б)15; (в) 14; (г) 16.
10*. Більше число протонів, ніж електронів, має
(а) атом Натрію; (в) сульфід-іон;
(б) атом Сульфуру; (г) йон Натрію.
11*. Атомне співвідношення ізотопів Літію з нуклонними числами 6 і 7 у природному елементі Li дорівнює, відповідно, 7,3 і 92,7 % (атомних відсотків). Середня відносна атомна маса елемента Літію дорівнює (а) 6,52; (б) 6,73; (в) 6,82; (г) 6,93.
12*. За поданими схемами напиши рівняння таких ядерних реакцій:

Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Плани-конспекти уроків з хімії, підручники з хімії за 8 клас, реферати з хімії
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|




















