|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Будова електронних оболонок атомів хiмічних елементів. Стан електронів у атомі. Енергетичні рівні та підрівні
СТАН ЕЛЕКТРОНІВ У АТОМІ
Тобі треба
мати уявлення: про рух електронів у атомі; спін електрона;
розуміти суть понять: орбіталь; електронна густина;
уміти: схематично позначати орбіталь з двома електронами, що мають протилежні спіни; характеризувати s- і р-орбіталі.
Відомо, що в атомі будь-якого елемента електрони рухаються. Вони не можуть бути нерухомими, бо під дією сили притягання до позитивно зарядженого ядра вони впали б на ядро. Але електрони не обертаються навколо ядра, як думали раніше (згадай планетарну (ядерну) модель атома Е. Резерфорда. Як же вони рухаються в атомі?
Щоб зрозуміти стан електрона в атомі, треба взяти до уваги подвійну природу електрона і той факт, що світ атома — це мікросвіт. Він не підкоряється законам, вияв яких ми звикли спостерігати в житті, тобто в умовах макросвіту. Рух електрона в атомі неможливо описати певною траєкторією (неперервною лінією, яку описує матеріальна точка як тіло під час руху). Можна говорити лише про більшу чи меншу ймовірність перебування електрона в обмеженому об'ємі простору біля ядра (можлива й нульова ймовірність). Рухаючись в атомі, електрон займає тривимірну ділянку простору біля ядра, що називається атомною орбіталлю.
Ділянка простору поблизу ядра, в якій найімовірніше перебування електрона, називається орбіталлю.
Зрозуміло, що чітко визначити межі орбіталі неможливо, вони розпливчасті. Електрон заповнює простір поблизу ядра у формі хвилі, яку можна уявити як «електронну хмару». Негативний заряд електрона виявляється «розмазаним» в усьому об'ємі простору біля ядра, яке оточене тривимірною електронною хмарою. Густина електронної хмари різна в різних місцях. У тих місцях, куди електрон потрапляє найчастіше, утворюється зона найбільшої електронної густини. У міру віддалення від ядра електронна густина дуже швидко зменшується й стає такою малою, що нею можна знехтувати.
Окрім руху біля ядра, електрон має ще свій власний рух — спін. Спрощено спін (від англ. spin — обертання) можна уявити як рух електрона навколо власної осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо власної осі за годинниковою стрілкою, а інший — проти годинникової стрілки), то це електрони з антипаралельними спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує умови для взаємного притягання електронів.
На одній орбіталі може перебувати лише два електрони, які мають протилежні спіни. Схематично атомну орбіталь позначають так:
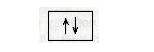
де квадрат (комірка) — це орбіталь, а стрілки — електрони з протилежними спінами. Одноелектронна орбіталь зображується так:
Файл:Одноелектронна орбіталь .jpg
Характеристика орбіталей. Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його електронна хмара (орбіталь) менша за розміром, але щільніша (електронна густина більша).
Орбіталі (електронні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись біля ядра, утворює електронну хмару сферичної форми (форма кулі). Такі орбіталі позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають s-електронами (мал. 11).
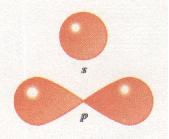
Мал. 11. Форми s- і р-орбіталей
Орбіталі, що мають сферичну форму, називаються s-орбіта-лями
р-Орбіталі мають гантелеподібну форму
Проте орбіталі можуть мати й іншу форму, наприклад форму гантелі (об'ємної «вісімки») або ще складнішу. Такі орбіталі позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами (див. мал. 11). Центри орбіталей збігаються з центром ядра.
р-Орбіталі відрізняються одна від одної розміщенням у просторі: вони розміщуються вздовж трьох взаємно перпендикулярних осей координат (мал. 12). Орбіталі складніших форм позначаються буквами d, f та ін.
Файл:Мал. 12. Схема взаємного розміщення р-орбіталей у просторі .jpg
Мал. 12. Схема взаємного розміщення р-орбіталей у просторі
Орбіталі різних форм відрізняються між собою ще й силою притягання до ядра, s-Електрони, орбіталі яких мають сферичну форму, притягуються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі. А електрони з іще складнішими формами орбіталей притягуються ще слабкіше.
ВИСНОВКИ
Електрони в атомі перебувають у постійному русі, але вони не обертаються навколо ядра, як планети навколо Сонця. Простежити шлях, по якому рухається електрон, неможливо, бо в нього немає траєкторії руху. Електрон займає тривимірну ділянку простору біля ядра, в якій його перебування найімовірніше. Таку ділянку простору прийнято називати орбіталлю.
Орбіталі бувають різної форми — s-, р-, d-, f-орбіталі. Орбіталі, що мають сферичну форму, називаються s-орбіталя-ми. р-Орбіталі мають гантелеподібну форму. Вони взаємно перпендикулярно орієнтовані у просторі вздовж осей х, у і z і позначаються відповідно рх, ру, pz. Найсильніше притягуються до ядра s-орбіталі, р-орбіталі слабкіше і т. д.
На одній орбіталі може перебувати не більше двох електронів.
Завдання для самоконтролю
1. Як ти уявляєш рух електрона в атомі хімічного елемента? Відповідь обґрунтуй.
2. Яку форму має: а) s-орбіталь; б) р-орбіталь? Намалюй їхні моделі.
3. Накресли три осі координат і намалюй уздовж них три р-орбіталі.
4. Виліпи з пластиліну модель s-орбіталі. За допомогою сірників зобрази її розміщення відносно осей координат. Так само виготуй моделі р-орбіталей і розмісти їх у просторі одну відносно одної.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Хімія 8 клас онлайн, підручники по всім предметам, плани уроків з хімії
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












