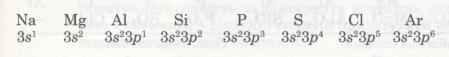|
|
|
| (1 промежуточная версия не показана) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Поняття про електронегативність елементів''' <metakeywords>Хімія, клас, урок, на Тему, Поняття про електронегативність елементів </metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Поняття про електронегативність елементів''' <metakeywords>Хімія, клас, урок, на Тему, Поняття про електронегативність елементів </metakeywords> <br> |
| | + | |
| | <br> | | <br> |
| - | Тут буде текст
| + | |
| | + | '''[[Тема_23._Електронна_природа_хiмічного_зв’язку._Електронегативність_елементів._Ковалентний_зв’язок._Електронні_формули_молекул_речовин|Електронегативність.]]''' Відносна легкість відривання [[Будова_атома._Електрон._Йон|електронів]] є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.<br>Електронегативністю елемента називають властивість його [[._Рух_і_взаємодія_атомів_і_молекул._Дифузія_.Повні_уроки|атомів]] відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).<br>Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд: |
| | + | |
| | + | F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs<br> |
| | + | |
| | + | [[Image:Лайнус Карл Полінг.jpg|Лайнус Карл Полінг. фото]] |
| | + | |
| | + | ''Мал. 22. Лайнус Карл Полінг.''<br>Лайнус Карл Полінг (1901—1994)<br>Американський [[Фізика_і_астрономія|фізик]] і[[Хімія|хімік]], громадський діяч, академік Національної академії наук США. Автор перших фундаментальних досліджень із застосування квантової механіки до вивчення хімічного зв'язку. Досліджував структуру білків, імунохімію, молекулярну генетику. Розрахував величини йонних радіусів, сформулював загальні правила утворення йонних кристалічних структур, пояснив напрям-леність валентностей. Виступав проти випробування ядерної зброї. Учасник руху прихильників миру в США. Лауреат Нобелівської премії з хімії (1954), Нобелівської премії миру (1962), Міжнародної Ленінської премії (1970)<br><br>Отже, найбільша здатність до притягання електронів у Флуору, а найменша — у Цезію.<br>Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі: |
| | + | |
| | + | '''''у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.'''''<br> |
| | + | |
| | + | <br>Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|зарядів ядер]] атомів кількість [[Валентність_хімічних_елементів._Визначення_валентності_за_формулами_бінарних_сполук|валентних]] електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.<br>Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.<br>Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів. |
| | + | |
| | + | [[Image:Ряд 1.jpg|Елементи третього періоду. фото]]<br>В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються. |
| | + | |
| | + | Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається [[Конспект_уроку_з_теми:_Лужні_метали._Натрій_і_Калій._Фізичні_та_хімічні_властивості_простих_речовин|лужним металом]] Калієм, який повторює переважно властивості Натрію.<br>Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:<br> |
| | + | |
| | + | [[Image:Ряд 2.jpg|Зміна значення вищої валентності елементів. фото]] |
| | | | |
| | <br> | | <br> |
| - | <sub>Онлайн бібліотека з підручниками і книгами, курс хімії для учнів 8 класу, реферати з хімії</sub> | + | |
| - | <br> | + | |
| | + | |
| | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту'' |
| | + | |
| | + | <br> <sub>[[Гіпермаркет Знань - перший в світі!|Онлайн]] бібліотека з підручниками і книгами, курс [[Хімія 8 клас|хімії]] для учнів 8 класу, реферати з хімії</sub> <br> |
| | + | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 07:31, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Поняття про електронегативність елементів
Електронегативність. Відносна легкість відривання електронів є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.
Електронегативністю елемента називають властивість його атомів відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).
Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд:
F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Мал. 22. Лайнус Карл Полінг.
Лайнус Карл Полінг (1901—1994)
Американський фізик іхімік, громадський діяч, академік Національної академії наук США. Автор перших фундаментальних досліджень із застосування квантової механіки до вивчення хімічного зв'язку. Досліджував структуру білків, імунохімію, молекулярну генетику. Розрахував величини йонних радіусів, сформулював загальні правила утворення йонних кристалічних структур, пояснив напрям-леність валентностей. Виступав проти випробування ядерної зброї. Учасник руху прихильників миру в США. Лауреат Нобелівської премії з хімії (1954), Нобелівської премії миру (1962), Міжнародної Ленінської премії (1970)
Отже, найбільша здатність до притягання електронів у Флуору, а найменша — у Цезію.
Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі:
у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.
Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання зарядів ядер атомів кількість валентних електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.
Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.
Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів.
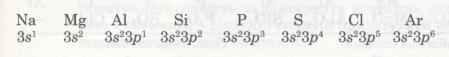
В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються.
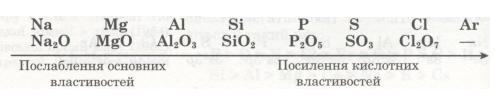
Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним металом Калієм, який повторює переважно властивості Натрію.
Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Онлайн бібліотека з підручниками і книгами, курс хімії для учнів 8 класу, реферати з хімії
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|