|
|
| Строка 1: |
Строка 1: |
| | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Електронні формули молекул речовин''' <metakeywords>Хімія, клас, урок, на Тему, Електронні формули молекул речовин </metakeywords> <br><br> | | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Електронні формули молекул речовин''' <metakeywords>Хімія, клас, урок, на Тему, Електронні формули молекул речовин </metakeywords> <br><br> |
| | | | |
| | + | <br> |
| | | | |
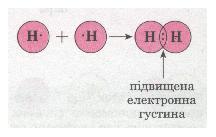
| | + | Для прикладу розглянемо утворення [[Інтерактивна_гра_до_уроку_«Будова_речовини._Атоми_і_молекули._Будова_атома»|молекули]] водню Н<sub>2</sub>. Тобі відомо, що кожний [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|атом]] [[Практичні_роботи:_1._Добування_вуглекислого_газу._Взаємоперетворення_карбонатів_і_гідрогенкарбонатів|Гідрогену]] має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу. |
| | | | |
| - | Для прикладу розглянемо утворення молекули водню Н<sub>2</sub>. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.
| + | <br>Якщо неспарений [[Валентність_хімічних_елементів._Визначення_валентності_за_формулами_бінарних_сполук|валентний]] [[Будова_атома._Електрон._Йон|електрон]] позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:<br> |
| | | | |
| - | <br>Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:<br>
| + | [[Image:Атоми Гідрогену в молекулі водню.jpg|Схема утворення хімічного зв'язку. фото]]<br> |
| | | | |
| - | [[Image:Атоми Гідрогену в молекулі водню.jpg]]<br> | + | [[Image:Підвищена електронна густина.jpg|Схема утворення хімічного зв'язку. фото]]<br> |
| | | | |
| - | [[Image:Підвищена електронна густина.jpg]]<br>
| + | ''Мал. 28. Схема утворення хімічного зв'язку.'' |
| | | | |
| - | Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н. | + | Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н. |
| | | | |
| | <br> | | <br> |
| | | | |
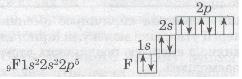
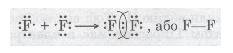
| - | <br> | + | Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F<sub>2</sub>. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений: |
| - | | + | |
| - | | + | |
| | | | |
| - | Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F<sub>2</sub>. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:
| + | [[Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg|Утворення ковалентного зв'язку. фото]]<br> |
| | | | |
| - | [[Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg]]<br>
| + | ''Мал. 29. Утворення ковалентного'' ''зв'язку.'' |
| | | | |
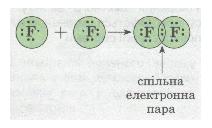
| | У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:<br> | | У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:<br> |
| | | | |
| - | [[Image:Перекривання хмар двох неспарених р-електронів.jpg]] | + | [[Image:Перекривання хмар двох неспарених р-електронів.jpg|Спільна електронна пара. фото]] |
| | | | |
| - | [[Image:Спільна ел. пара -2.jpg]] | + | [[Image:Спільна ел. пара -2.jpg|Спільна електронна пара. фото]] |
| | | | |
| - | У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.
| + | ''Мал. 30. Спільна електронна пара.'' |
| | | | |
| - | <br>
| + | У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів. |
| | | | |
| | <br> | | <br> |
| | | | |
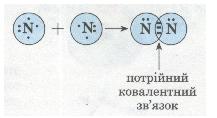
| - | Схема утворення потрійного ковалентного зв'язку в молекулі азоту N<sub>2</sub>:<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N.jpg]]<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N - 2.jpg]] | + | Схема утворення потрійного ковалентного зв'язку в молекулі азоту N<sub>2</sub>:<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N.jpg|Схема утворення потрійного ковалентного зв'язку в молекулі азоту N2. фото]]<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N - 2.jpg|Схема утворення потрійного ковалентного зв'язку в молекулі азоту N2. фото]] |
| | | | |
| | <br> | | <br> |
| | | | |
| - | <br>
| + | ''Мал. 31. Схема утворення потрійного ковалентного зв'язку в молекулі азоту N2'' |
| | | | |
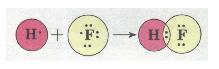
| | Ковалентний полярний зв'язок у молекулі флуороводню HF:<br> | | Ковалентний полярний зв'язок у молекулі флуороводню HF:<br> |
| | | | |
| - | [[Image:Ковалентний полярний зв'язок у молекулі флуороводню HF.jpg]] | + | [[Image:Ковалентний полярний зв'язок у молекулі флуороводню HF.jpg|Ковалентний полярний зв'язок у молекулі флуороводню HF. фото]] |
| | | | |
| - | [[Image:Молекула флуороводню HF- 2 .jpg]] | + | [[Image:Молекула флуороводню HF- 2 .jpg|Ковалентний полярний зв'язок у молекулі флуороводню HF. фото]] |
| | | | |
| | <br> | | <br> |
| | | | |
| - | <br>
| + | ''Мал. 32. Ковалентний полярний зв'язок у молекулі флуороводню HF.'' |
| | | | |
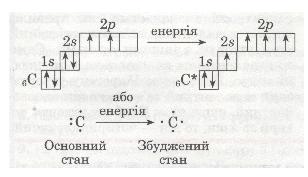
| | Згадаємо електронну формулу Карбону:<br><sub>6</sub>С 1s<sup>2</sup>2s<sup>2</sup>2p<sup>2</sup><br>Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:<br> | | Згадаємо електронну формулу Карбону:<br><sub>6</sub>С 1s<sup>2</sup>2s<sup>2</sup>2p<sup>2</sup><br>Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:<br> |
| | | | |
| - | [[Image:Розпаровування електронної пари атом Карбону.jpg]]<br>Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами, наприклад:<br> [[Image:4 ковалентні зв'язки Карбону з іншими атомами .jpg]] | + | [[Image:Розпаровування електронної пари атом Карбону.jpg| Розпарювання. фото]] |
| | | | |
| - | <br> | + | ''Мал. 33. Розпарювання.''<br>Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами. |
| | | | |
| - | ----
| + | <br> |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту<br> | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту''<br> |
| | | | |
| - | <br> <sub>Матеріали та завдання з [[Хімія|хімії]], допомога школяру, готуємось до школи [[Гіпермаркет_Знань_-_перший_в_світі!|онлайн]]</sub> <br> | + | <br> <sub>Матеріали та завдання з [[Хімія|хімії]], допомога школяру, готуємось до школи [[Гіпермаркет Знань - перший в світі!|онлайн]]</sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> | | <br> |
Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.
У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.