|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Хімія: Склад і властивості основних класів неорганічних сполук''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Склад і властивості основних класів неорганічних сполук'''<metakeywords>Хімія, клас, урок, на тему, 9 клас, Склад і властивості основних класів неорганічних сполук.</metakeywords> |
| | | | |
| - | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Склад і властивості основних класів неорганічних сполук.</metakeywords>СКЛАД І ВЛАСТИВОСТІ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК<br>
| + | |
| | + | |
| | + | СКЛАД І ВЛАСТИВОСТІ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК<br> |
| | | | |
| | <br> | | <br> |
| Строка 7: |
Строка 9: |
| | ВІТАЮ ВАС, ДЕВ'ЯТИКЛАСНИКИ!<br> | | ВІТАЮ ВАС, ДЕВ'ЯТИКЛАСНИКИ!<br> |
| | | | |
| - | Цього року ви завершите опанування азів хімічної науки в основній школі. Тож по закінченні дев'ятого класу зможете більш-менш об'єктивно оцінити, чи сприяло вивчення хімії підвищенню вашої загальної ерудиції, чи допомогло ліпше пізнати себе і навколишній світ, вибрати професію до душі й навчальний заклад для подальшого навчання.<br> | + | Цього року ви завершите опанування азів [[Хімія|хімічної науки]] в основній школі. Тож по закінченні дев'ятого класу зможете більш-менш об'єктивно оцінити, чи сприяло вивчення хімії підвищенню вашої загальної ерудиції, чи допомогло ліпше пізнати себе і навколишній світ, вибрати професію до душі й навчальний заклад для подальшого навчання.<br> |
| | | | |
| - | Ви, безперечно, знаєте, як працювати з текстом підручника, й умієте, за потреби, знаходити пояснення нових термінів у тлумачному словничку та інших джерелах інформації - додатковій навчальній літературі, науково-популярних і художніх виданнях, Інтернеті тощо. Принагідно зауважу, що нові слова, зокрема іншомовного походження, які трапляються в тексті, запам'ятовувати необов'язково. На цих прикладах ви лише розвинете уміння використовувати довідковий апарат підручника, який правитиме за модель різноманітних джерел інформації. Терміни, значення яких треба знайти в тлумачному словничку, підкреслено. Таку форму виокремлення обрано свідомо й цілеспрямовано. Адже вам обов'язково доведеться (а багатьом уже доводилося) працювати з інформаційними джерелами на електронних носіях, зокрема у режимі «on-line». у яких гіпертекстові посилання традиційно виокремлюють саме у такий спосіб.<br> | + | Ви, безперечно, знаєте, як працювати з текстом підручника, й умієте, за потреби, знаходити пояснення нових термінів у тлумачному словничку та інших джерелах інформації - додатковій [[Тема_1._Ознайомлення_учнів_із_завданнями_і_структурою_курсу._Побудова_підручника._Додаткова_навчальна_література_та_електронні_ресурс|навчальній літературі]], науково-популярних і художніх виданнях, [[Ілюстрації_на_тему_«Глобальна_мережа_Інтернет»|Інтернеті ]]тощо. Принагідно зауважу, що нові слова, зокрема іншомовного походження, які трапляються в тексті, запам'ятовувати необов'язково. На цих прикладах ви лише розвинете уміння використовувати довідковий апарат підручника, який правитиме за модель різноманітних джерел інформації. Терміни, значення яких треба знайти в тлумачному словничку, підкреслено. Таку форму виокремлення обрано свідомо й цілеспрямовано. Адже вам обов'язково доведеться (а багатьом уже доводилося) працювати з інформаційними джерелами на електронних носіях, зокрема у режимі «on-line». у яких гіпертекстові посилання традиційно виокремлюють саме у такий спосіб.<br> |
| | | | |
| - | Підручник хімії виконуватиме функції своєрідного «тренажеру», на якому ви зможете вправлятися у сприйнятті та обробці інформації різного формату - алгоритмічних приписів, табличних даних, графіків, діаграм. Вироблення навичок сприймати інформацію й після належної обробки застосовувати у практичній діяльності забезпечить зростання вашої інформаційної компетентності. Вам доведеться виокремлювати головне в інформаційному повідомленні, вчитися розуміти різні формати формулювань завдань, обґрунтовувати власні висловлення.<br> | + | Підручник [[Хімія|хімії ]]виконуватиме функції своєрідного «тренажеру», на якому ви зможете вправлятися у сприйнятті та обробці інформації різного формату - алгоритмічних приписів, табличних даних, графіків, діаграм. Вироблення навичок сприймати інформацію й після належної обробки застосовувати у практичній діяльності забезпечить зростання вашої інформаційної компетентності. Вам доведеться виокремлювати головне в інформаційному повідомленні, вчитися розуміти різні формати формулювань завдань, обґрунтовувати власні висловлення.<br> |
| | | | |
| | Яке призначення рубрики «Стисло про головне»? Вона допоможе вам швидко пригадати й усвідомити найважливіше з того, про що йшлося у параграфі, здійснити самоконтроль.<br> | | Яке призначення рубрики «Стисло про головне»? Вона допоможе вам швидко пригадати й усвідомити найважливіше з того, про що йшлося у параграфі, здійснити самоконтроль.<br> |
| Строка 21: |
Строка 23: |
| | Завдання, наведені у рубриці «Застосуйте свої знання й уміння», призначені для виконання як під час роботи на уроці, так і для домашньої самостійної роботи. Ви маєте самі визначити обсяг роботи - кількість завдань і різноманітність достатні, аби кожен вибрав собі ті, які йому по силах і до снаги. Приміром, завдання, позначені *, виконувати необов'язково, однак остаточне рішення - за вами. Ваш найперший порадник у цьому - вчитель хімії. Хто як не він знає рівень навчальних можливостей, схильності та уподобання своїх вихованців і охоче допоможе правильно визначити обсяг домашнього завдання. | | Завдання, наведені у рубриці «Застосуйте свої знання й уміння», призначені для виконання як під час роботи на уроці, так і для домашньої самостійної роботи. Ви маєте самі визначити обсяг роботи - кількість завдань і різноманітність достатні, аби кожен вибрав собі ті, які йому по силах і до снаги. Приміром, завдання, позначені *, виконувати необов'язково, однак остаточне рішення - за вами. Ваш найперший порадник у цьому - вчитель хімії. Хто як не він знає рівень навчальних можливостей, схильності та уподобання своїх вихованців і охоче допоможе правильно визначити обсяг домашнього завдання. |
| | | | |
| - | На яку кількість уроків розраховане вивчення одного параграфа? Поміж параграфів підручника переважають такі, для вивчення яких достатньо одного уроку. Деякі параграфи ви вивчатимете на кількох уроках - вони містять більшу порцію інформації й, відповідно, більшу кількість завдань. Зверніть увагу: матеріал, позначений * та виокремлений дрібнішим шрифтом, подано для ознайомлення, а не для запам'ятовування.<br> | + | На яку кількість [[9_клас_уроки|уроків]] розраховане вивчення одного параграфа? Поміж параграфів підручника переважають такі, для вивчення яких достатньо одного уроку. Деякі параграфи ви вивчатимете на кількох уроках - вони містять більшу порцію інформації й, відповідно, більшу кількість завдань. Зверніть увагу: матеріал, позначений * та виокремлений дрібнішим шрифтом, подано для ознайомлення, а не для запам'ятовування.<br> |
| | | | |
| | Ви вдосконалюватимете вміння сприймати альтернативні точки зору й висловлювати обґрунтовані аргументи за й проти кожної з них. | | Ви вдосконалюватимете вміння сприймати альтернативні точки зору й висловлювати обґрунтовані аргументи за й проти кожної з них. |
| Строка 29: |
Строка 31: |
| | Ці вміння неодмінно стануть вам у пригоді під час виконання завдань рубрики «Скарбничка досвіду». Зрозуміло, що всі їх виконати навряд чи можливо та й недоцільно. Вибирайте з них ті, що вам до душі. Залучайте до співпраці однокласників, друзів, членів родини, радьтеся з учителями - і скарбничка поступово наповнюватиметься. Згодом її вміст перетвориться на своєрідний «стартовий капітал», який допоможе вам стати успішною самодостатньою людиною. | | Ці вміння неодмінно стануть вам у пригоді під час виконання завдань рубрики «Скарбничка досвіду». Зрозуміло, що всі їх виконати навряд чи можливо та й недоцільно. Вибирайте з них ті, що вам до душі. Залучайте до співпраці однокласників, друзів, членів родини, радьтеся з учителями - і скарбничка поступово наповнюватиметься. Згодом її вміст перетвориться на своєрідний «стартовий капітал», який допоможе вам стати успішною самодостатньою людиною. |
| | | | |
| - | Цього року ви вдосконалите вміння складати план експерименту, виконувати досліди відповідно до ПРАВИЛ ТЕХНІКИ БЕЗПЕКИ {пригадайте, яких саме), описувати спостереження та на основі їхнього аналізу робити висновки. | + | Цього року ви вдосконалите вміння складати план експерименту, виконувати досліди відповідно до [[Практичні_роботи:_1._Правила_техніки_безпеки_під_час_роботи_в_хімічному_кабінеті.|ПРАВИЛ ТЕХНІКИ БЕЗПЕКИ]] {пригадайте, яких саме), описувати спостереження та на основі їхнього аналізу робити висновки. |
| | | | |
| | Розрахункові задачі нових типів також є важливою складовою курсу хімії 9-го класу. Розв'язуючи задачі, ви не тільки звертатиметесь до алгоритмічних приписів підручника, а й робитимете спроби самостійно складати їх, шукатимете власні нестандартні підходи. | | Розрахункові задачі нових типів також є важливою складовою курсу хімії 9-го класу. Розв'язуючи задачі, ви не тільки звертатиметесь до алгоритмічних приписів підручника, а й робитимете спроби самостійно складати їх, шукатимете власні нестандартні підходи. |
| Строка 41: |
Строка 43: |
| | <br> | | <br> |
| | | | |
| - | [[Image:Chemistry Mendeleev 01 2.jpg]][[Image:Chemistry Mendeleev 02 2.jpg]]<br> | + | [[Image:Chemistry Mendeleev 01 2.jpg|Періодична система хімічних елементів. фото]][[Image:Chemistry Mendeleev 02 2.jpg|Періодична система хімічних елементів. фото]]<br> |
| | + | |
| | + | ''Мал. 1. Періодична система хімічних елементів.'' |
| | | | |
| - | <br> | + | [[Image:Chemistry tablica 01 1.jpg|Розчинність кислот, основ і солей у воді. фото]] [[Image:Chemistry tablica 02 2.jpg|Розчинність кислот, основ і солей у воді. фото]]<br> |
| | | | |
| - | [[Image:Chemistry_tablica_01_1.jpg]] [[Image:Chemistry_tablica_02_2.jpg]]<br>
| + | ''Мал. 2. Розчинність кислот, основ і солей у воді.'' |
| | | | |
| | <br> | | <br> |
| | | | |
| - | <u>Склад і властивості основних класів неорганічних сполук</u><br>
| + | '''Склад і властивості основних класів неорганічних сполук'''<br> |
| | | | |
| - | Аби відповісти на запитання: що таке оксиди, кислоти, солі, індикатори? Де ці сполуки трапляються у природі та побуті? Як оксиди, кислоти, солі називають за сучасною науковою номенклатурою та у який спосіб класифікують? Які властивості цих сполук і чим вони зумовлені? Яким чином представники різних класів неорганічних сполук пов'язані між собою? Для чого їх застосовують і чому? - пригадайте курс хімії 8-го класу, проаналізуйте схеми, виконайте тестові завдання й здійсніть самоконтроль.<br> | + | Аби відповісти на запитання: що таке [[12._Оксиди,_їх_склад,_назви|оксиди]], [[13._Кислоти,_їх_склад,_назви|кислоти]], [[14._Солі_(середні),_їх_склад,_назви|солі]], [[20._Фізичні_та_хімічні_властивості_кислот:_дія_на_індикатори,_взаємодія_з_металами._Класифiкація_кислот._Поняття_про_ряд_активності_металів|індикатори]]? Де ці сполуки трапляються у природі та побуті? Як оксиди, кислоти, солі називають за сучасною науковою номенклатурою та у який спосіб класифікують? Які властивості цих сполук і чим вони зумовлені? Яким чином представники різних класів неорганічних сполук пов'язані між собою? Для чого їх застосовують і чому? - пригадайте курс хімії 8-го класу, проаналізуйте схеми, виконайте тестові завдання й здійсніть самоконтроль.<br> |
| | | | |
| | Виконаймо тестове завдання - установімо відповідність між визначеннями та назвами.<br> | | Виконаймо тестове завдання - установімо відповідність між визначеннями та назвами.<br> |
| Строка 58: |
Строка 62: |
| | |- | | |- |
| | | | | | |
| - | 1 Складні речовини, утворені катіонами металічних елементів та аніонами гідроксильних груп<br> | + | ''1 Складні речовини, утворені катіонами металічних елементів та аніонами гідроксильних груп<br>'' |
| | | | |
| - | 2 Бінарні сполуки елементів з Оксигеном, у яких атоми Оксигену між собою хімічно безпосередньо не зв'язані<br> | + | ''2 Бінарні сполуки елементів з Оксигеном, у яких атоми Оксигену між собою хімічно безпосередньо не зв'язані<br>'' |
| | | | |
| - | 3 Складні речовини, утворені катіонами металічних елементів та аніонами кислотних залишків<br> | + | ''3 Складні речовини, утворені катіонами металічних елементів та аніонами кислотних залишків<br>'' |
| | | | |
| - | 4 Речовини, що після введення до розчину змінюють свій колір і таким чином дають змогу визначити хімічну <br> | + | ''4 Речовини, що після введення до розчину змінюють свій колір і таким чином дають змогу визначити хімічну <br>'' |
| | | | |
| - | природу розчину | + | ''природу розчину'' |
| | | | |
| | | | | | |
| Строка 85: |
Строка 89: |
| | Отже, ви пригадали, що таке оксиди, основи, солі та індикатори. Кислоти — це складні речовини, у молекулах яких атоми Гідрогену сполучені з кислотними залишками. | | Отже, ви пригадали, що таке оксиди, основи, солі та індикатори. Кислоти — це складні речовини, у молекулах яких атоми Гідрогену сполучені з кислотними залишками. |
| | | | |
| - | [[Image:6 chemistry.jpg]] | + | [[Image:6 chemistry.jpg|Приклади представників основних класів неорганічних сполук. фото]] |
| | | | |
| | Розгляньмо приклади оксидів, основ, кислот, солей, наведені на малюнку 1.1.<br> | | Розгляньмо приклади оксидів, основ, кислот, солей, наведені на малюнку 1.1.<br> |
| | | | |
| - | ''• Де ''оксиди, основи, кислоти, солі трапляються у природі та побуті? Для чого їх застосовують та чому?<br> | + | ''• Де оксиди, основи, кислоти, солі трапляються у природі та побуті? Для чого їх застосовують та чому?''<br> |
| | | | |
| | Оксиди бувають твердими, як-от: кварц Si0<sub>2</sub>, корунд А1<sub>2</sub>0<sub>3</sub>, гематит Fe<sub>2</sub>0<sub>3</sub>, рідкими, наприклад вода Н<sub>2</sub>0, та газуватими - вуглекислий газ С0<sub>2</sub>, сірчистий газ S0<sub>2</sub>.<br> | | Оксиди бувають твердими, як-от: кварц Si0<sub>2</sub>, корунд А1<sub>2</sub>0<sub>3</sub>, гематит Fe<sub>2</sub>0<sub>3</sub>, рідкими, наприклад вода Н<sub>2</sub>0, та газуватими - вуглекислий газ С0<sub>2</sub>, сірчистий газ S0<sub>2</sub>.<br> |
| Строка 101: |
Строка 105: |
| | Солі вам теж добре відомі: кухонна сіль (натрій хлорид), питна сода (натрій гідрогенкарбонат, крейда (кальцій карбонат), «марганцівка» (калій перманганат).<br> | | Солі вам теж добре відомі: кухонна сіль (натрій хлорид), питна сода (натрій гідрогенкарбонат, крейда (кальцій карбонат), «марганцівка» (калій перманганат).<br> |
| | | | |
| - | ''• Як ''оксиди, основи, кислоти, солі називають за сучасною науковою номенклатурою?<br> | + | ''• Як оксиди, основи, кислоти, солі називають за сучасною науковою номенклатурою?''<br> |
| | | | |
| | Назвімо за сучасною науковою номенклатурою оксид, хімічна формула якого N0<sub>2</sub>, за таким алгоритмом: 1. Запишемо назву неметалічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви хімічного елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «оксид». Отже, назва сполуки - нітроген(ІV) оксид.<br> | | Назвімо за сучасною науковою номенклатурою оксид, хімічна формула якого N0<sub>2</sub>, за таким алгоритмом: 1. Запишемо назву неметалічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви хімічного елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «оксид». Отже, назва сполуки - нітроген(ІV) оксид.<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Назвіть за сучасною науковою номенклатурою оксид, хімічна формула якого S0<sub>3</sub>.<br> | + | ''Назвіть за сучасною науковою номенклатурою оксид, хімічна формула якого S0<sub>3</sub>.''<br> |
| | | | |
| | Назвімо за сучасною науковою номенклатурою основу, формула якої Fе(ОН)<sub>2</sub>, за таким алгоритмом: 1. Запишемо назву металічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «гідроксид». Отже, назва сполуки - ферум(ІІ) гідроксид.<br> | | Назвімо за сучасною науковою номенклатурою основу, формула якої Fе(ОН)<sub>2</sub>, за таким алгоритмом: 1. Запишемо назву металічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «гідроксид». Отже, назва сполуки - ферум(ІІ) гідроксид.<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АІ(ОН)<sub>3</sub>.<br> | + | ''Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АІ(ОН)<sub>3</sub>.<br>'' |
| | | | |
| - | Установімо відповідність між хімічними формулами та назвами найважливіших кислот, виконавши тестове завдання (зверніть увагу: у назвах кислот виокремлено назви кислотних залишків). | + | ''Установімо відповідність між хімічними формулами та назвами найважливіших кислот, виконавши тестове завдання (зверніть увагу: у назвах кислот виокремлено назви кислотних залишків).'' |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" width="600" | | {| cellspacing="1" cellpadding="1" border="1" width="600" |
| | |- | | |- |
| | | | | | |
| - | Хімічна формула<br> | + | ''Хімічна формула<br>'' |
| | | | |
| - | 1 Н<sub>2</sub>S0<sub>4</sub><br>2 Н<sub>2</sub>Sі0<sub>3</sub><br>3 Н<sub>2</sub>S0<sub>3</sub><br>4 Н<sub>3</sub>Р0<sub>4</sub><br>5 Н<sub>2</sub>S<br>6 HCl<br>7 HNO<sub>2</sub> | + | ''1 Н<sub>2</sub>S0<sub>4</sub><br>2 Н<sub>2</sub>Sі0<sub>3</sub><br>3 Н<sub>2</sub>S0<sub>3</sub><br>4 Н<sub>3</sub>Р0<sub>4</sub><br>5 Н<sub>2</sub>S<br>6 HCl<br>7 HNO<sub>2</sub>'' |
| | | | |
| | | | | | |
| - | Кислота<br> | + | ''Кислота<br>'' |
| | | | |
| - | А ''Хлорид''на<br>Б ''Сульфат''на<br>В ''Нітрат''на<br>Г ''Ортофосфат''на<br>Д ''Силікат''на<br>Ж ''Сульфіт''на<br>3 ''Сульфід''на<br>К ''Нітрит''на
| + | ''А Хлоридна<br>Б Сульфатна<br>В Нітратна<br>Г Ортофосфатна<br>Д Силікатна<br>Ж Сульфітна<br>3 Сульфідна<br>К Нітритна'' |
| | | | |
| | |} | | |} |
| Строка 133: |
Строка 137: |
| | Відповідь. 1 - Б. 2 - Д. З - Ж. 4 - Г. 5 - 3. 6 - А. 7 - К. <br> | | Відповідь. 1 - Б. 2 - Д. З - Ж. 4 - Г. 5 - 3. 6 - А. 7 - К. <br> |
| | | | |
| - | Формула нітратної кислоти НNО<sub>3</sub>.<br> | + | ''Формула нітратної кислоти НNО<sub>3</sub>.<br>'' |
| | | | |
| - | Назвімо за сучасною науковою номенклатурою сіль, формула якої СuСl<sub>2</sub>, за таким алгоритмом: 1. Запишемо назву металічного елемента в називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо назву кислотного залишку. Отже, назва сполуки - купрум(ІІ) хлорид.<br> | + | ''Назвімо за сучасною науковою номенклатурою сіль, формула якої СuСl<sub>2</sub>, за таким алгоритмом: 1. Запишемо назву металічного елемента в називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо назву кислотного залишку. Отже, назва сполуки - купрум(ІІ) хлорид.''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АgN0<sub>3</sub>.<br> | + | ''Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АgN0<sub>3</sub>.''<br> |
| | | | |
| - | <u>''Цікаво?''</u><br>Тривіальні назви речовин вражають розмаїттям і загадковістю, втім, здебільшого, не дають уявлення про хімічний склад речовин. Наприклад, НgО - кіновар, ZnS - філософська вовна, К<sub>2</sub>С0<sub>3</sub> - поташ, НСІ - мурієва кислота, Н<sub>2</sub>S0<sub>4</sub> - купоросна олія, АgN0<sub>3</sub> - ляпіс, пекельний камінь, NaОН - каустична сода, МgО - палена магнезія, СаО - палене вапно, НF - плавикова кислота тощо.<br>
| + | '''''Цікаво?'''''<br>Тривіальні назви речовин вражають розмаїттям і загадковістю, втім, здебільшого, не дають уявлення про хімічний склад речовин. Наприклад, НgО - кіновар, ZnS - філософська вовна, К<sub>2</sub>С0<sub>3</sub> - поташ, НСІ - мурієва кислота, Н<sub>2</sub>S0<sub>4</sub> - купоросна олія, АgN0<sub>3</sub> - ляпіс, пекельний камінь, NaОН - каустична сода, МgО - палена магнезія, СаО - палене вапно, НF - плавикова кислота тощо.<br> |
| | | | |
| - | ''• У який спосіб класифікують ''оксиди, основи, кислоти, солі? | + | ''• У який спосіб класифікують ''''оксиди, основи, кислоти, солі?'' |
| | | | |
| - | [[Image:8 chemistry.jpg]] | + | [[Image:8 chemistry.jpg|завдання. фото]] |
| | | | |
| - | ''<u>Завдання</u>''<br> | + | '''Завдання'''<br> |
| | | | |
| - | Установіть відповідність між оксидами та їхнім хімічним характером.<br> | + | ''Установіть відповідність між оксидами та їхнім хімічним характером.<br>'' |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" width="300" | | {| cellspacing="1" cellpadding="1" border="1" width="300" |
| | |- | | |- |
| | | | | | |
| - | Оксид | + | ''Оксид'' |
| | | | |
| - | 1 MgO<br> | + | ''1 MgO<br>'' |
| | | | |
| - | 2 P<sub>2</sub>O<sub>5</sub><br> | + | ''2 P<sub>2</sub>O<sub>5</sub><br>'' |
| | | | |
| - | 3 Al<sub>2</sub>O<sub>3</sub><br> | + | ''3 Al<sub>2</sub>O<sub>3</sub><br>'' |
| | | | |
| | | | | | |
| - | Хімічний характер | + | ''Хімічний характер'' |
| | | | |
| - | А Основний | + | ''А Основний'' |
| | | | |
| - | Б Кислотний | + | ''Б Кислотний'' |
| | | | |
| - | В Несолетворний | + | ''В Несолетворний'' |
| | | | |
| - | Г Амфотерний | + | ''Г Амфотерний'' |
| | | | |
| | |} | | |} |
| Строка 183: |
Строка 187: |
| | Відповідь. 1 - В. 2 - Б. З - А.<br> | | Відповідь. 1 - В. 2 - Б. З - А.<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| | Розташуйте кислоти за зменшенням їхньої основності: А Сульфідна кислота; Б Ортофосфатна кислота; В Нітритна кислота<br> | | Розташуйте кислоти за зменшенням їхньої основності: А Сульфідна кислота; Б Ортофосфатна кислота; В Нітритна кислота<br> |
| Строка 189: |
Строка 193: |
| | За якісним складом кислоти класифікують за наявністю або відсутністю атомів Оксигену в молекулах. Наприклад, нітратна кислота (HN0<sub>3</sub>) - оксигеновмісна, а бромідна (НВr) - безоксигенова.<br> | | За якісним складом кислоти класифікують за наявністю або відсутністю атомів Оксигену в молекулах. Наприклад, нітратна кислота (HN0<sub>3</sub>) - оксигеновмісна, а бромідна (НВr) - безоксигенова.<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Виберіть безоксигенові кислоти:<br> | + | ''Виберіть безоксигенові кислоти:<br>'' |
| | | | |
| - | А Сульфатна кислота; Б Сульфідна кислота; В Хлоридна кислота; Г Силікатна кислота <br> | + | ''А Сульфатна кислота; Б Сульфідна кислота; В Хлоридна кислота; Г Силікатна кислота <br>'' |
| | | | |
| - | Основи поділяють на луги і нерозчинні основи. Луги - йонні кристалічні речовини білого кольору, милкі на дотик, розчинні у воді, їдкі (LiOH, NaOH, КОН, Mg(OH)<sub>2</sub>, Са(ОН)<sub>2</sub>, Sr(OH)<sub>2</sub>). Нерозчинні основи - це йонні речовини різних кольорів, нерозчинні у воді (Fe(OH)<sub>2</sub>, Сг(ОН)<sub>2</sub>, Мn(ОН)<sub>2</sub>).<br> | + | ''Основи поділяють на луги і нерозчинні основи. Луги - йонні кристалічні речовини білого кольору, милкі на дотик, розчинні у воді, їдкі (LiOH, NaOH, КОН, Mg(OH)<sub>2</sub>, Са(ОН)<sub>2</sub>, Sr(OH)<sub>2</sub>). Нерозчинні основи - це йонні речовини різних кольорів, нерозчинні у воді (Fe(OH)<sub>2</sub>, Сг(ОН)<sub>2</sub>, Мn(ОН)<sub>2</sub>).''<br> |
| | | | |
| - | ''<u>Завдання</u>''<br> | + | '''Завдання'''<br> |
| | | | |
| - | Користуючись таблицею «Розчинність кислот, основ, солей у воді» (див. додаток), виберіть луг.<br> | + | ''Користуючись таблицею «Розчинність кислот, основ, солей у воді» (див. додаток), виберіть луг.<br>'' |
| | | | |
| - | А Цинк гідроксид; Б Барій гідроксид; В Нікель(ІІ) гідроксид; Г Купрум(ІІ) гідроксид<br> | + | ''А Цинк гідроксид; Б Барій гідроксид; В Нікель(ІІ) гідроксид; Г Купрум(ІІ) гідроксид<br>'' |
| | | | |
| - | ''• Як виявляють ''кислоти і луги у розчинах?<br> | + | ''• Як виявляють кислоти і луги у розчинах?''<br> |
| | | | |
| - | Розчини кислот і лугів можна розрізнити за зміною кольору індикаторів. Наприклад, у кислому середовищі метиловий оранжевий змінює колір на рожевий, фенолфталеїн у лужному - на малиновий. Універсальний індикаторний папір у лужному середовищі стає синім, у кислому набуває червоного кольору.<br> | + | Розчини кислот і [[26._Хімічні_властивості_лугів._Реакція_нейтралізації._Заходи_безпеки_під_час_роботи_з_лугами._Використання_лугів|лугів]] можна розрізнити за зміною кольору індикаторів. Наприклад, у кислому середовищі метиловий оранжевий змінює колір на рожевий, фенолфталеїн у лужному - на малиновий. Універсальний індикаторний папір у лужному середовищі стає синім, у кислому набуває червоного кольору.<br> |
| | | | |
| - | Установіть відповідність між речовинами та забарвленням індикаторів:<br> | + | ''Установіть відповідність між речовинами та забарвленням індикаторів:<br>'' |
| | | | |
| - | а) | + | ''а)'' |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" width="400" | | {| cellspacing="1" cellpadding="1" border="1" width="400" |
| | |- | | |- |
| | | | | | |
| - | Речовина<br> | + | ''Речовина<br>'' |
| | | | |
| - | 1 HCl<br>2 NaOH<br> | + | ''1 HCl<br>2 NaOH<br>'' |
| | | | |
| | | | | | |
| - | Індикатор, забарвлення | + | ''Індикатор, забарвлення'' |
| | | | |
| - | А Фенолфталеїн, малиновий<br>Б Універсальний індикатор, жовтий<br>В Метиловий оранжевий, рожевий | + | ''А Фенолфталеїн, малиновий<br>Б Універсальний індикатор, жовтий<br>В Метиловий оранжевий, рожевий'' |
| | | | |
| | |} | | |} |
| | | | |
| - | б)<br> | + | ''б)<br>'' |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" width="400" | | {| cellspacing="1" cellpadding="1" border="1" width="400" |
| | |- | | |- |
| | | | | | |
| - | Речовина | + | ''Речовина'' |
| | | | |
| - | 1 Н<sub>2</sub>S0<sub>4</sub><br>2 Н<sub>2</sub>0 | + | ''1 Н<sub>2</sub>S0<sub>4</sub><br>2 Н<sub>2</sub>0'' |
| | | | |
| | | | | | |
| - | Індикатор, забарвлення | + | ''Індикатор, забарвлення'' |
| | | | |
| - | А Фенолфталеїн, малиновий<br>Б Універсальний індикатор, червоний<br>В Метиловий оранжевий, оранжевий | + | ''А Фенолфталеїн, малиновий<br>Б Універсальний індикатор, червоний<br>В Метиловий оранжевий, оранжевий'' |
| | | | |
| | |} | | |} |
| | | | |
| - | ''<br>• Які хімічні ''властивості виявляють оксиди, основи, кислоти, солі? | + | ''<br>• Які хімічні ''''властивості виявляють оксиди, основи, кислоти, солі?'' |
| | | | |
| | Розгляньмо загальні схеми взаємодії між представниками різних класів неорганічних сполук і конкретні приклади до них. | | Розгляньмо загальні схеми взаємодії між представниками різних класів неорганічних сполук і конкретні приклади до них. |
| Строка 251: |
Строка 255: |
| | Кислоти у розчинах не реагують із тими металами, які у ряду активності (с. 105, мал. 14.4) розташовані після водню: Н<sub>2</sub>S0<sub>4</sub> + Аu → | | Кислоти у розчинах не реагують із тими металами, які у ряду активності (с. 105, мал. 14.4) розташовані після водню: Н<sub>2</sub>S0<sub>4</sub> + Аu → |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Завдання''' |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. <br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. <br>'' |
| | | | |
| - | НСІ + Мg→ МgСІ<sub>2</sub> + Н<sub>2</sub>↑ | + | ''НСІ + Мg→ МgСІ<sub>2</sub> + Н<sub>2</sub>↑'' |
| | | | |
| - | Кислота + основний або амфотерний оксид → сіль + вода <br> | + | ''Кислота + основний або амфотерний оксид → сіль + вода <br>'' |
| | | | |
| - | 2НNO<sub>3</sub> + MgO = Мg(NО<sub>3</sub>)<sub>2</sub> + Н<sub>2</sub>0 | + | ''2НNO<sub>3</sub> + MgO = Мg(NО<sub>3</sub>)<sub>2</sub> + Н<sub>2</sub>0'' |
| | | | |
| - | 2НСl + ВеО = ВеСl<sub>2</sub> + Н<sub>2</sub>0 | + | ''2НСl + ВеО = ВеСl<sub>2</sub> + Н<sub>2</sub>0'' |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Завдання''' |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br>'' |
| | | | |
| - | НСІ + СuО → СuСІ<sub>2</sub> + Н<sub>2</sub>0 | + | ''НСІ + СuО → СuСІ<sub>2</sub> + Н<sub>2</sub>0'' |
| | | | |
| - | Кислота + основа → сіль + вода <br> | + | ''Кислота + основа → сіль + вода <br>'' |
| | | | |
| - | 2НNОз + Са(ОН)<sub>2</sub> = Са(N0<sub>3</sub>)<sub>2</sub> + 2Н<sub>2</sub>0 | + | ''2НNОз + Са(ОН)<sub>2</sub> = Са(N0<sub>3</sub>)<sub>2</sub> + 2Н<sub>2</sub>0'' |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Завдання''' |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.'' |
| | | | |
| - | Н<sub>2</sub>S0<sub>4</sub> + NaОН -> Nа<sub>2</sub>S0<sub>4</sub> + Н<sub>2</sub>0<br> | + | ''Н<sub>2</sub>S0<sub>4</sub> + NaОН -> Nа<sub>2</sub>S0<sub>4</sub> + Н<sub>2</sub>0<br>'' |
| | | | |
| - | Кислота' + сіль' → сіль" + кислота"<br> | + | ''Кислота' + сіль' → сіль" + кислота"<br>'' |
| | | | |
| - | Сильні й нелеткі кислоти витісняють слабкі, леткі, нестійкі кислоти з їхніх солей:<br> | + | ''Сильні й нелеткі кислоти витісняють слабкі, леткі, нестійкі кислоти з їхніх солей:<br>'' |
| | | | |
| - | 2HN0<sub>3</sub> + СаС0<sub>3</sub> = Ca(N0<sub>3</sub>)<sub>2</sub> + C0<sub>2</sub>↑ + Н<sub>2</sub>0 <br> | + | ''2HN0<sub>3</sub> + СаС0<sub>3</sub> = Ca(N0<sub>3</sub>)<sub>2</sub> + C0<sub>2</sub>↑ + Н<sub>2</sub>0 <br>'' |
| | | | |
| - | H<sub>2</sub>S + NaCl [[Image:Znak1 chemistry.jpg]]<br> | + | ''H<sub>2</sub>S + NaCl [[Image:Znak1 chemistry.jpg]]''<br> |
| | | | |
| - | ''<u>Завдання</u>''<br> | + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.'' |
| | | | |
| - | HCl + Na<sub>2</sub>S → NaCl + H<sub>2</sub>S↑<br> | + | ''HCl + Na<sub>2</sub>S → NaCl + H<sub>2</sub>S↑<br>'' |
| | | | |
| - | Луг + кислотний або амфотерний оксид → сіль + вода <br> | + | ''Луг + кислотний або амфотерний оксид → сіль + вода <br>'' |
| | | | |
| - | 2КОН + С0<sub>2</sub> = К<sub>2</sub>С0<sub>3</sub> + Н<sub>2</sub>0 <br> | + | ''2КОН + С0<sub>2</sub> = К<sub>2</sub>С0<sub>3</sub> + Н<sub>2</sub>0 <br>'' |
| | | | |
| - | 2NaOH + ВеО + Н<sub>2</sub>0 = Na<sub>2</sub>[Be(OH)<sub>4</sub>]*<br> | + | ''2NaOH + ВеО + Н<sub>2</sub>0 = Na<sub>2</sub>[Be(OH)<sub>4</sub>]*''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти, продукти.<br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти, продукти.<br>'' |
| | | | |
| - | NaOH + S0<sub>3</sub> → Na<sub>2</sub>S0<sub>4 </sub>+ Н<sub>2</sub>0<br> | + | ''NaOH + S0<sub>3</sub> → Na<sub>2</sub>S0<sub>4 </sub>+ Н<sub>2</sub>0<br>'' |
| | | | |
| - | Луг' + сіль' → основа" + сіль"<br> | + | ''Луг' + сіль' → основа" + сіль"<br>'' |
| | | | |
| - | Реакція між солями й лугами у розчині відбувається, якщо хоча б одиг з її продуктів - нерозчинна речовина:<br> | + | ''Реакція між солями й лугами у розчині відбувається, якщо хоча б одиг з її продуктів - нерозчинна речовина:<br>'' |
| | | | |
| - | 2КОН + CuS0<sub>4</sub> = Cu(OH)<sub>2</sub>↓+ K<sub>2</sub>S0<sub>4</sub><br> | + | ''2КОН + CuS0<sub>4</sub> = Cu(OH)<sub>2</sub>↓+ K<sub>2</sub>S0<sub>4</sub>''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. <br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. <br>'' |
| | | | |
| - | Ва(ОН)<sub>2</sub> + Na<sub>2</sub>C0<sub>3</sub> → NaOH + ВаС0<sub>3</sub>↓<br> | + | ''Ва(ОН)<sub>2</sub> + Na<sub>2</sub>C0<sub>3</sub> → NaOH + ВаС0<sub>3</sub>↓<br>'' |
| | | | |
| - | Основний оксид + вода → луг <br> | + | ''Основний оксид + вода → луг <br>'' |
| | | | |
| - | З водою реагують оксиди металічних елементів ІА і ІІБ (починаючи з Магнію) груп періодичної системи:<br> | + | ''З водою реагують оксиди металічних елементів ІА і ІІБ (починаючи з Магнію) груп періодичної системи:<br>'' |
| | | | |
| - | СаО + Н<sub>2</sub>0 = Са(ОН)<sub>2</sub><br> | + | ''СаО + Н<sub>2</sub>0 = Са(ОН)<sub>2</sub>''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br>'' |
| | | | |
| - | Li<sub>2</sub>0 + Н<sub>2</sub>0 → LiOH<br> | + | ''Li<sub>2</sub>0 + Н<sub>2</sub>0 → LiOH<br>'' |
| | | | |
| - | Кислотний оксид + вода → кислота<br> | + | ''Кислотний оксид + вода → кислота<br>'' |
| | | | |
| - | SO<sub>2</sub> + Н<sub>2</sub>0 = H<sub>2</sub>S0<sub>3</sub><br> | + | ''SO<sub>2</sub> + Н<sub>2</sub>0 = H<sub>2</sub>S0<sub>3</sub>''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br>'' |
| | | | |
| - | SO<sub>3</sub> + Н<sub>2</sub>0 → H<sub>2</sub>S0<sub>4</sub><br> | + | ''SO<sub>3</sub> + Н<sub>2</sub>0 → H<sub>2</sub>S0<sub>4</sub><br>'' |
| | | | |
| - | Пригадайте літній відпочинок на пісковому пляжі й назвіть кислотний оксид, який не реагує з водою. За потреби зверніться до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток).<br> | + | ''Пригадайте літній відпочинок на пісковому пляжі й назвіть кислотний оксид, який не реагує з водою. За потреби зверніться до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток).<br>'' |
| | | | |
| - | Основний оксид + кислотний оксид → сіль<br> | + | ''Основний оксид + кислотний оксид → сіль<br>'' |
| | | | |
| - | МgО + SО<sub>3</sub> = МgS0<sub>4</sub><br> | + | ''МgО + SО<sub>3</sub> = МgS0<sub>4</sub>''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br>'' |
| | | | |
| - | СаО + С0<sub>2</sub> → СаС0<sub>3</sub> <br> | + | ''СаО + С0<sub>2</sub> → СаС0<sub>3</sub> <br>'' |
| | | | |
| - | Сіль' + метал' → сіль" + метал"<br> | + | ''Сіль' + метал' → сіль" + метал"<br>'' |
| | | | |
| - | Кожний попередній метал (починаючи від магнію) у ряду активності (с.105, мал.14.4) витісняє наступні з розчинів їхніх солей:<br> | + | ''Кожний попередній метал (починаючи від магнію) у ряду активності (с.105, мал.14.4) витісняє наступні з розчинів їхніх солей:<br>'' |
| | | | |
| - | CuCl<sub>2</sub> + Zп = ZnCl<sub>2</sub> + Cu↓<br>СuСl<sub>2</sub> + Аg [[Image:Znak1 chemistry.jpg]]<br> | + | ''CuCl<sub>2</sub> + Zп = ZnCl<sub>2</sub> + Cu↓<br>СuСl<sub>2</sub> + Аg [[Image:Znak1 chemistry.jpg]]''<br> |
| | | | |
| - | <u>''Завдання''</u><br>
| + | '''Завдання'''<br> |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br> | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.<br>'' |
| | | | |
| - | СuS0<sub>4</sub> + Fе → FеS0<sub>4</sub> + Сu↓<br> | + | ''СuS0<sub>4</sub> + Fе → FеS0<sub>4</sub> + Сu↓<br>'' |
| | | | |
| - | Сіль' + сіль" → сіль"' + сіль""<br> | + | ''Сіль' + сіль" → сіль"' + сіль""<br>'' |
| | | | |
| - | NaСІ + АgN0<sub>3</sub> = АgСІ↓ + NaNO<sub>3</sub><br> | + | ''NaСІ + АgN0<sub>3</sub> = АgСІ↓ + NaNO<sub>3</sub>''<br> |
| | | | |
| - | ''<u>Завдання</u>'' | + | '''Завдання''' |
| | | | |
| - | Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. | + | ''Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.'' |
| | | | |
| - | МgS0<sub>4</sub> + ВаСІ<sub>2</sub> → ВаS0<sub>4</sub>↓+ МgСІ<sub>2</sub> | + | ''МgS0<sub>4</sub> + ВаСІ<sub>2</sub> → ВаS0<sub>4</sub>↓+ МgСІ<sub>2</sub>'' |
| | | | |
| - | Як представники різних класів неорганічних сполук пов'язані між собою? Розібратися у цьому допоможе малюнок 1.2. | + | ''Як представники різних класів неорганічних сполук пов'язані між собою? Розібратися у цьому допоможе малюнок 1.2.'' |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Завдання''' |
| | | | |
| - | Доповніть генетичний ряд кальцію формулою основи. | + | ''Доповніть генетичний ряд кальцію формулою основи.'' |
| | | | |
| - | Са → СаО → ? → СаСІ<sub>2</sub> | + | ''Са → СаО → ? → СаСІ<sub>2</sub>'' |
| | | | |
| - | Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій. | + | ''Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій.'' |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Завдання''' |
| | | | |
| - | Доповніть генетичний ряд сірки. | + | ''Доповніть генетичний ряд сірки.'' |
| | | | |
| - | S → ? → Н<sub>2</sub>SО<sub>3</sub> → Nа<sub>2</sub>S0<sub>3</sub> | + | ''S → ? → Н<sub>2</sub>SО<sub>3</sub> → Nа<sub>2</sub>S0<sub>3</sub>'' |
| | | | |
| - | Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій. | + | ''Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій.'' |
| | | | |
| - | [[Image:11 chemistry.jpg]] | + | [[Image:11 chemistry.jpg|Генетичні зв'язки неорганічних сполук. фото]] |
| | | | |
| | Отже, між класами неорганічних сполук існують зв'язки, які називають генетичними. Генетичний зв'язок полягає у тому, що з речовин одного класу неорганічних сполук можна одержати речовини - представники інших класів. До генетичного ряду речовин входять представники різних класів неорганічних сполук одного й того ж хімічного елемента. Вони мають єдине походження - генезис - і пов'язані взаємоперетвореннями. | | Отже, між класами неорганічних сполук існують зв'язки, які називають генетичними. Генетичний зв'язок полягає у тому, що з речовин одного класу неорганічних сполук можна одержати речовини - представники інших класів. До генетичного ряду речовин входять представники різних класів неорганічних сполук одного й того ж хімічного елемента. Вони мають єдине походження - генезис - і пов'язані взаємоперетвореннями. |
| Строка 397: |
Строка 401: |
| | Властивості речовин істотно залежать від їхнього хімічного складу. Застосування речовин зумовлене їхніми властивостями. | | Властивості речовин істотно залежать від їхнього хімічного складу. Застосування речовин зумовлене їхніми властивостями. |
| | | | |
| - | Встановімо відповідність між складом, властивостями і застосуванням ортофосфатної кислоти. | + | ''Встановімо відповідність між складом, властивостями і застосуванням ортофосфатної кислоти.'' |
| | | | |
| - | ''Ортофосфатна кислота:''<br>1 Одноосновна<br>2 Трьохосновна<br>3 Чотирьохосновна<br>''Тому що її молекула містить:''<br>А Один атом Фосфору<br>В Три атоми Гідрогену<br>С Чотири атоми Оксигену<br>''Вона реагує з оксидами:''<br>I Основними та амфотерними<br>II Тільки кислотними<br>III Основними та кислотними<br>''Тому її застосовують для:''<br>а Підкислення солодких газованих напоїв<br>b Видалення іржі<br>Відповідь: 2, В, І, b.<br> | + | ''Ортофосфатна кислота:<br>1 Одноосновна<br>2 Трьохосновна<br>3 Чотирьохосновна<br>Тому що її молекула містить:<br>А Один атом Фосфору<br>В Три атоми Гідрогену<br>С Чотири атоми Оксигену<br>Вона реагує з оксидами:<br>I Основними та амфотерними<br>II Тільки кислотними<br>III Основними та кислотними<br>Тому її застосовують для:<br>а Підкислення солодких газованих напоїв<br>b Видалення іржі<br>Відповідь: 2, В, І, b.''<br> |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Завдання''' |
| | | | |
| - | Встановіть відповідність між складом, властивостями і застосуванням магній гідроксиду.<br>''Хімічний характер магній гідроксиду:''<br>1 Кислотний<br>2 Основний<br>З Амфотерний<br>''Тому що він реагує:''<br>А Тільки з кислотами<br>В Тільки з лугами<br>С І з кислотами, і з лугами<br>''Ця властивість зумовила його застосування як:''<br>I Антацидного засобу (проти печії)<br>II Барвника<br>III Каталізатора | + | ''Встановіть відповідність між складом, властивостями і застосуванням магній гідроксиду.<br>Хімічний характер магній гідроксиду:<br>1 Кислотний<br>2 Основний<br>З Амфотерний<br>Тому що він реагує:<br>А Тільки з кислотами<br>В Тільки з лугами<br>С І з кислотами, і з лугами<br>Ця властивість зумовила його застосування як:<br>I Антацидного засобу (проти печії)<br>II Барвника<br>III Каталізатора'' |
| | | | |
| | Отже, ви повторили склад і властивості представників основних класів неорганічних сполук, генетичні зв'язки між ними. Ці знання й уміння луже важливі. Вони знадобляться вам під час вивчення теми «Розчини». | | Отже, ви повторили склад і властивості представників основних класів неорганічних сполук, генетичні зв'язки між ними. Ці знання й уміння луже важливі. Вони знадобляться вам під час вивчення теми «Розчини». |
| | | | |
| - | <u>''Стисло про головне''</u>
| + | '''Стисло про головне''' |
| | | | |
| | Оксиди, основи, кислоти, солі - основні класи неорганічних сполук. | | Оксиди, основи, кислоти, солі - основні класи неорганічних сполук. |
| Строка 419: |
Строка 423: |
| | Між представниками основних класів неорганічних сполук існують генетичні зв'язки. Застосування речовин зумовлене їхніми властивостями. | | Між представниками основних класів неорганічних сполук існують генетичні зв'язки. Застосування речовин зумовлене їхніми властивостями. |
| | | | |
| - | <u>''Застосуйте свої знання й уміння''</u>
| + | '''Застосуйте свої знання й уміння''' |
| | | | |
| - | 1. З наведеного переліку виберіть формули речовин, які належать до генетичного ряду магнію: Са, Н<sub>2</sub>0, Мg(N0<sub>3</sub>)<sub>2</sub>, МgСІ<sub>2</sub>, S, Н<sub>2</sub>S0<sub>4</sub>, Na<sub>3</sub>Р0<sub>4</sub>, 0<sub>2</sub>, Мg(ОН)<sub>2</sub>, SОз, Мg, МgО. | + | ''1. З наведеного переліку виберіть формули речовин, які належать до генетичного ряду магнію: Са, Н<sub>2</sub>0, Мg(N0<sub>3</sub>)<sub>2</sub>, МgСІ<sub>2</sub>, S, Н<sub>2</sub>S0<sub>4</sub>, Na<sub>3</sub>Р0<sub>4</sub>, 0<sub>2</sub>, Мg(ОН)<sub>2</sub>, SОз, Мg, МgО.'' |
| | | | |
| - | 2. Проаналізуйте хімічні формули речовин з наведених переліків, назвіть їх і класифікуйте:<br>а) МgSОз, ВаО, Н<sub>2</sub>S0<sub>4</sub>, Fе(ОН)<sub>3</sub>, Ва, S0<sub>3</sub>, ВаСІ<sub>2</sub>, Ва(ОН)<sub>2</sub>, НВг;<br>б) S, НN0<sub>3</sub>, ZnСl<sub>2</sub>, S0<sub>2</sub>, Сu(ОН)<sub>2</sub>, Na<sub>2</sub>S0<sub>3</sub>, Н<sub>2</sub>0, Н<sub>2</sub>S0<sub>3</sub>, LiOН, СаО, НСІ;<br>в) СuО, Н<sub>3</sub>РО<sub>4</sub>, С, Н<sub>2</sub>С0<sub>3</sub>, С0<sub>2</sub>, Са(ОН)<sub>2</sub>, К<sub>2</sub>С0<sub>3</sub>, СuSO<sub>4, </sub>Fе(ОН)<sub>2</sub>, НІ;<br>г) SіО<sub>2</sub>, К<sub>2</sub>0, Мg(ОН)<sub>2</sub>, Sі, NaОН, Н<sub>2</sub>Sі0<sub>3</sub>, Na, АgСІ, К<sub>2</sub>Sі0<sub>3</sub>, НF, АІ<sub>2</sub>0<sub>3</sub>. | + | ''2. Проаналізуйте хімічні формули речовин з наведених переліків, назвіть їх і класифікуйте:<br>а) МgSОз, ВаО, Н<sub>2</sub>S0<sub>4</sub>, Fе(ОН)<sub>3</sub>, Ва, S0<sub>3</sub>, ВаСІ<sub>2</sub>, Ва(ОН)<sub>2</sub>, НВг;<br>б) S, НN0<sub>3</sub>, ZnСl<sub>2</sub>, S0<sub>2</sub>, Сu(ОН)<sub>2</sub>, Na<sub>2</sub>S0<sub>3</sub>, Н<sub>2</sub>0, Н<sub>2</sub>S0<sub>3</sub>, LiOН, СаО, НСІ;<br>в) СuО, Н<sub>3</sub>РО<sub>4</sub>, С, Н<sub>2</sub>С0<sub>3</sub>, С0<sub>2</sub>, Са(ОН)<sub>2</sub>, К<sub>2</sub>С0<sub>3</sub>, СuSO<sub>4, </sub>Fе(ОН)<sub>2</sub>, НІ;<br>г) SіО<sub>2</sub>, К<sub>2</sub>0, Мg(ОН)<sub>2</sub>, Sі, NaОН, Н<sub>2</sub>Sі0<sub>3</sub>, Na, АgСІ, К<sub>2</sub>Sі0<sub>3</sub>, НF, АІ<sub>2</sub>0<sub>3</sub>.'' |
| | | | |
| - | 3. Складіть рівняння хімічних реакцій, які відображають генетичні зв'язки літію й вуглецю, та між представниками цих рядів. | + | ''3. Складіть рівняння хімічних реакцій, які відображають генетичні зв'язки літію й вуглецю, та між представниками цих рядів.'' |
| | | | |
| | <br> | | <br> |
| | | | |
| - | ''Автор'' ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | + | ''Автор'' ''Г. А. Лашевська, [[Хімія_9_клас|Хімія, 9 клас]]<br>Вислано читачами з інтернет-сайтів '' |
| | | | |
| | <br> <sub>Онлайн [[Гіпермаркет Знань - перший в світі!|бібліотека]] з підручниками і книгами [[Хімія|з хімії]], плани-конспекти уроків по всім предметам, завдання [[Хімія 9 клас|з хімії для 9 класу]]</sub> | | <br> <sub>Онлайн [[Гіпермаркет Знань - перший в світі!|бібліотека]] з підручниками і книгами [[Хімія|з хімії]], плани-конспекти уроків по всім предметам, завдання [[Хімія 9 клас|з хімії для 9 класу]]</sub> |
| Строка 436: |
Строка 440: |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> | | <br> |
Текущая версия на 09:09, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Склад і властивості основних класів неорганічних сполук
СКЛАД І ВЛАСТИВОСТІ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК
ВІТАЮ ВАС, ДЕВ'ЯТИКЛАСНИКИ!
Цього року ви завершите опанування азів хімічної науки в основній школі. Тож по закінченні дев'ятого класу зможете більш-менш об'єктивно оцінити, чи сприяло вивчення хімії підвищенню вашої загальної ерудиції, чи допомогло ліпше пізнати себе і навколишній світ, вибрати професію до душі й навчальний заклад для подальшого навчання.
Ви, безперечно, знаєте, як працювати з текстом підручника, й умієте, за потреби, знаходити пояснення нових термінів у тлумачному словничку та інших джерелах інформації - додатковій навчальній літературі, науково-популярних і художніх виданнях, Інтернеті тощо. Принагідно зауважу, що нові слова, зокрема іншомовного походження, які трапляються в тексті, запам'ятовувати необов'язково. На цих прикладах ви лише розвинете уміння використовувати довідковий апарат підручника, який правитиме за модель різноманітних джерел інформації. Терміни, значення яких треба знайти в тлумачному словничку, підкреслено. Таку форму виокремлення обрано свідомо й цілеспрямовано. Адже вам обов'язково доведеться (а багатьом уже доводилося) працювати з інформаційними джерелами на електронних носіях, зокрема у режимі «on-line». у яких гіпертекстові посилання традиційно виокремлюють саме у такий спосіб.
Підручник хімії виконуватиме функції своєрідного «тренажеру», на якому ви зможете вправлятися у сприйнятті та обробці інформації різного формату - алгоритмічних приписів, табличних даних, графіків, діаграм. Вироблення навичок сприймати інформацію й після належної обробки застосовувати у практичній діяльності забезпечить зростання вашої інформаційної компетентності. Вам доведеться виокремлювати головне в інформаційному повідомленні, вчитися розуміти різні формати формулювань завдань, обґрунтовувати власні висловлення.
Яке призначення рубрики «Стисло про головне»? Вона допоможе вам швидко пригадати й усвідомити найважливіше з того, про що йшлося у параграфі, здійснити самоконтроль.
Для чого у підручнику наведено тестові завдання різних форм? їхнє виконання не лише сприятиме закріпленню вивченого, а й удосконаленню вмінь працювати з тестовими завданнями взагалі. Ці вміння нагодяться вам під час проходження зовнішнього незалежного оцінювання.
Чи всі завдання виконувати? Завдання в основному тексті параграфів спрямовані на актуалізацію наявних і закріплення щойно здобутих знань, тому не варто залишати їх поза увагою. До того ж у такий спосіб ви змінюєте вид діяльності, це «розвантажує» мозок і сприяє розв'язанню проблем на рівні підсвідомості.
Завдання, наведені у рубриці «Застосуйте свої знання й уміння», призначені для виконання як під час роботи на уроці, так і для домашньої самостійної роботи. Ви маєте самі визначити обсяг роботи - кількість завдань і різноманітність достатні, аби кожен вибрав собі ті, які йому по силах і до снаги. Приміром, завдання, позначені *, виконувати необов'язково, однак остаточне рішення - за вами. Ваш найперший порадник у цьому - вчитель хімії. Хто як не він знає рівень навчальних можливостей, схильності та уподобання своїх вихованців і охоче допоможе правильно визначити обсяг домашнього завдання.
На яку кількість уроків розраховане вивчення одного параграфа? Поміж параграфів підручника переважають такі, для вивчення яких достатньо одного уроку. Деякі параграфи ви вивчатимете на кількох уроках - вони містять більшу порцію інформації й, відповідно, більшу кількість завдань. Зверніть увагу: матеріал, позначений * та виокремлений дрібнішим шрифтом, подано для ознайомлення, а не для запам'ятовування.
Ви вдосконалюватимете вміння сприймати альтернативні точки зору й висловлювати обґрунтовані аргументи за й проти кожної з них.
Ви знаходитимете необхідну інформацію в різних джерелах, систематизуватимете запропоновану або самостійно підібрану інформацію за певними ознаками. До того ж вам доведеться переводити зорову інформацію у словесну знакову систему й навпаки.
Ці вміння неодмінно стануть вам у пригоді під час виконання завдань рубрики «Скарбничка досвіду». Зрозуміло, що всі їх виконати навряд чи можливо та й недоцільно. Вибирайте з них ті, що вам до душі. Залучайте до співпраці однокласників, друзів, членів родини, радьтеся з учителями - і скарбничка поступово наповнюватиметься. Згодом її вміст перетвориться на своєрідний «стартовий капітал», який допоможе вам стати успішною самодостатньою людиною.
Цього року ви вдосконалите вміння складати план експерименту, виконувати досліди відповідно до ПРАВИЛ ТЕХНІКИ БЕЗПЕКИ {пригадайте, яких саме), описувати спостереження та на основі їхнього аналізу робити висновки.
Розрахункові задачі нових типів також є важливою складовою курсу хімії 9-го класу. Розв'язуючи задачі, ви не тільки звертатиметесь до алгоритмічних приписів підручника, а й робитимете спроби самостійно складати їх, шукатимете власні нестандартні підходи.
Зміст, біографічні довідки й портрети науковців, відомості з рубрики «Цікаво? Корисно! Пізнавально!», предметний та іменний покажчики тощо допоможуть вам ефективно використовувати підручник як джерело знань, розширити ерудицію.
Пам'ятайте, що гармонійний розвиток інтелекту неможливий без знань основ хімії. Тож не шкодуйте зусиль на їхнє вивчення - це допоможе вам стати конкурентоспроможними та успішними особистостями, справжніми громадянами і патріотами України.
Я вірю у вас, УЧНІ, й зичу успіху!
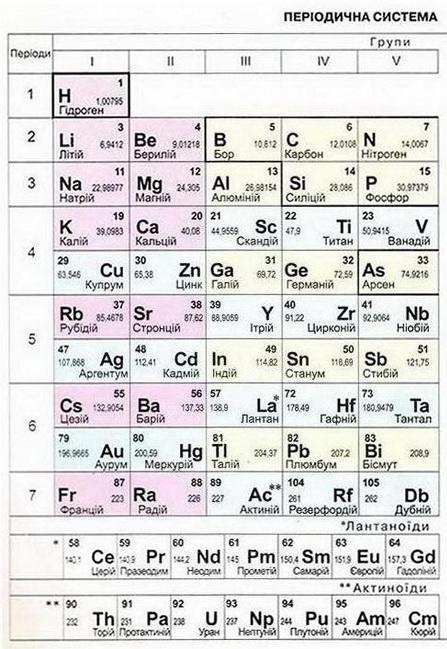 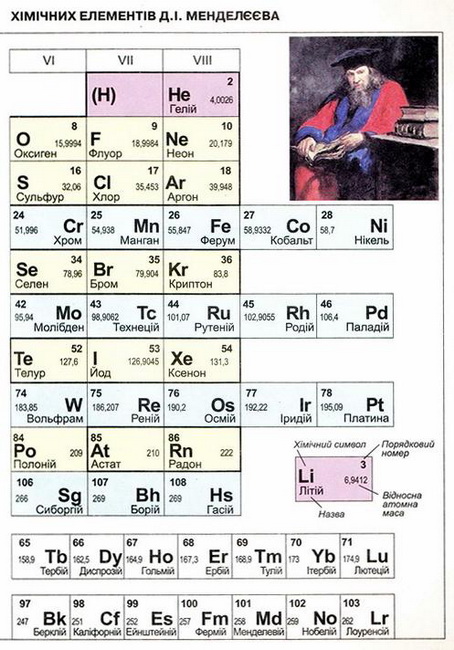
Мал. 1. Періодична система хімічних елементів.
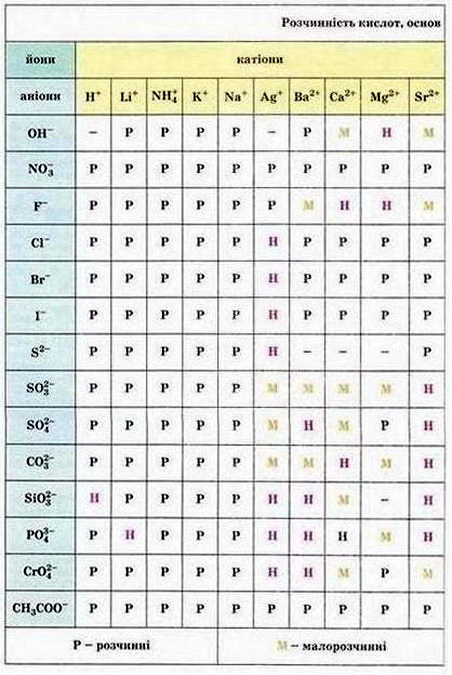 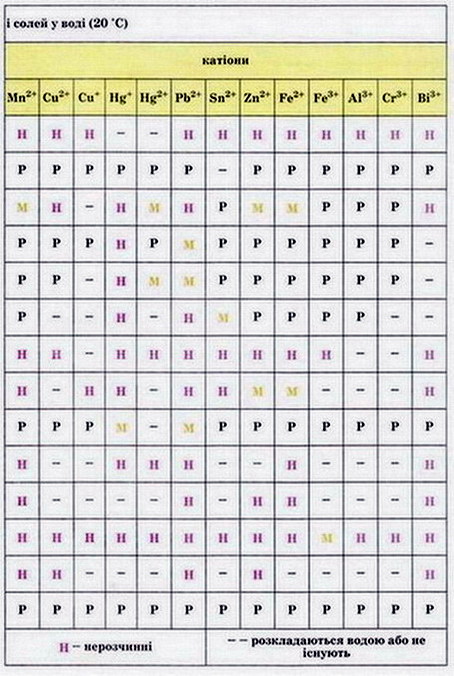
Мал. 2. Розчинність кислот, основ і солей у воді.
Склад і властивості основних класів неорганічних сполук
Аби відповісти на запитання: що таке оксиди, кислоти, солі, індикатори? Де ці сполуки трапляються у природі та побуті? Як оксиди, кислоти, солі називають за сучасною науковою номенклатурою та у який спосіб класифікують? Які властивості цих сполук і чим вони зумовлені? Яким чином представники різних класів неорганічних сполук пов'язані між собою? Для чого їх застосовують і чому? - пригадайте курс хімії 8-го класу, проаналізуйте схеми, виконайте тестові завдання й здійсніть самоконтроль.
Виконаймо тестове завдання - установімо відповідність між визначеннями та назвами.
|
1 Складні речовини, утворені катіонами металічних елементів та аніонами гідроксильних груп
2 Бінарні сполуки елементів з Оксигеном, у яких атоми Оксигену між собою хімічно безпосередньо не зв'язані
3 Складні речовини, утворені катіонами металічних елементів та аніонами кислотних залишків
4 Речовини, що після введення до розчину змінюють свій колір і таким чином дають змогу визначити хімічну
природу розчину
|
А Оксиди
Б Основи
В Кислоти
Г Солі
Д Індикатори
|
Відповідь. 1 - Б. 2 - А. З - Г. 4 - Д.
Отже, ви пригадали, що таке оксиди, основи, солі та індикатори. Кислоти — це складні речовини, у молекулах яких атоми Гідрогену сполучені з кислотними залишками.
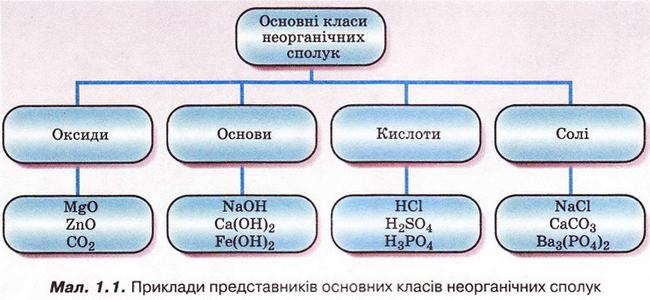
Розгляньмо приклади оксидів, основ, кислот, солей, наведені на малюнку 1.1.
• Де оксиди, основи, кислоти, солі трапляються у природі та побуті? Для чого їх застосовують та чому?
Оксиди бувають твердими, як-от: кварц Si02, корунд А1203, гематит Fe203, рідкими, наприклад вода Н20, та газуватими - вуглекислий газ С02, сірчистий газ S02.
Чимало мінералів і руд містять оксиди. Оксиди застосовують у промисловості й повсякденному житті. Багато з них є небезпечними для здоров'я людини і довкілля. Щоб ефективно й безпечно використовувати оксиди, дуже важливо знати їхні властивості та фізіологічну дію.
Неорганічні кислоти також поширені у нашому житті. Приміром, шлунковий сік містить хлоридну кислоту HCl. Сульфатна кислота H2S04 - складова автомобільного акумулятора. Карбонатна Н2С03 та ортофосфатна Н3Р04 кислоти - компоненти солодких газованих напоїв. Лікувальна вода «Нафтуся» має специфічний запах сірководню - адже до її складу входить сульфідна кислота H2S.
Основи у нашому житті - це засоби для прочищення каналізаційних труб і видалення жирових забруднень (містять натрій гідроксид), елементи живлення (містять гідроксиди Натрію, Калію, Літію), складові будівельних розчинів (кальцій гідроксид або гашене вапно) тощо.
Солі вам теж добре відомі: кухонна сіль (натрій хлорид), питна сода (натрій гідрогенкарбонат, крейда (кальцій карбонат), «марганцівка» (калій перманганат).
• Як оксиди, основи, кислоти, солі називають за сучасною науковою номенклатурою?
Назвімо за сучасною науковою номенклатурою оксид, хімічна формула якого N02, за таким алгоритмом: 1. Запишемо назву неметалічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви хімічного елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «оксид». Отже, назва сполуки - нітроген(ІV) оксид.
Завдання
Назвіть за сучасною науковою номенклатурою оксид, хімічна формула якого S03.
Назвімо за сучасною науковою номенклатурою основу, формула якої Fе(ОН)2, за таким алгоритмом: 1. Запишемо назву металічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «гідроксид». Отже, назва сполуки - ферум(ІІ) гідроксид.
Завдання
Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АІ(ОН)3.
Установімо відповідність між хімічними формулами та назвами найважливіших кислот, виконавши тестове завдання (зверніть увагу: у назвах кислот виокремлено назви кислотних залишків).
|
Хімічна формула
1 Н2S04
2 Н2Sі03
3 Н2S03
4 Н3Р04
5 Н2S
6 HCl
7 HNO2
|
Кислота
А Хлоридна
Б Сульфатна
В Нітратна
Г Ортофосфатна
Д Силікатна
Ж Сульфітна
3 Сульфідна
К Нітритна
|
Відповідь. 1 - Б. 2 - Д. З - Ж. 4 - Г. 5 - 3. 6 - А. 7 - К.
Формула нітратної кислоти НNО3.
Назвімо за сучасною науковою номенклатурою сіль, формула якої СuСl2, за таким алгоритмом: 1. Запишемо назву металічного елемента в називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо назву кислотного залишку. Отже, назва сполуки - купрум(ІІ) хлорид.
Завдання
Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АgN03.
Цікаво?
Тривіальні назви речовин вражають розмаїттям і загадковістю, втім, здебільшого, не дають уявлення про хімічний склад речовин. Наприклад, НgО - кіновар, ZnS - філософська вовна, К2С03 - поташ, НСІ - мурієва кислота, Н2S04 - купоросна олія, АgN03 - ляпіс, пекельний камінь, NaОН - каустична сода, МgО - палена магнезія, СаО - палене вапно, НF - плавикова кислота тощо.
• У який спосіб класифікують 'оксиди, основи, кислоти, солі?

Завдання
Установіть відповідність між оксидами та їхнім хімічним характером.
|
Оксид
1 MgO
2 P2O5
3 Al2O3
|
Хімічний характер
А Основний
Б Кислотний
В Несолетворний
Г Амфотерний
|
Кислоти класифікують за основністю і за якісним складом. Основність у формулі кислоти визначають за кількістю атомів Гідрогену, здатних заміститися на атоми металічного елемента. Наприклад, нітратна кислота (HNO3) - одноосновна, сульфітна кислота (H2S03) - двохосновна, ортофосфатна кислота (Н3Р04) - трьохосновна. Порада: пригадати хімічні формули найважливіших кислот вам допоможе таблиця «Розчинність кислот, основ, солей у воді» (див. додаток).
Розташуймо кислоти за зростанням їхньої основності:
А Ортофосфатна кислота; Б Сульфатна кислота; В Хлоридна кислота.
Відповідь. 1 - В. 2 - Б. З - А.
Завдання
Розташуйте кислоти за зменшенням їхньої основності: А Сульфідна кислота; Б Ортофосфатна кислота; В Нітритна кислота
За якісним складом кислоти класифікують за наявністю або відсутністю атомів Оксигену в молекулах. Наприклад, нітратна кислота (HN03) - оксигеновмісна, а бромідна (НВr) - безоксигенова.
Завдання
Виберіть безоксигенові кислоти:
А Сульфатна кислота; Б Сульфідна кислота; В Хлоридна кислота; Г Силікатна кислота
Основи поділяють на луги і нерозчинні основи. Луги - йонні кристалічні речовини білого кольору, милкі на дотик, розчинні у воді, їдкі (LiOH, NaOH, КОН, Mg(OH)2, Са(ОН)2, Sr(OH)2). Нерозчинні основи - це йонні речовини різних кольорів, нерозчинні у воді (Fe(OH)2, Сг(ОН)2, Мn(ОН)2).
Завдання
Користуючись таблицею «Розчинність кислот, основ, солей у воді» (див. додаток), виберіть луг.
А Цинк гідроксид; Б Барій гідроксид; В Нікель(ІІ) гідроксид; Г Купрум(ІІ) гідроксид
• Як виявляють кислоти і луги у розчинах?
Розчини кислот і лугів можна розрізнити за зміною кольору індикаторів. Наприклад, у кислому середовищі метиловий оранжевий змінює колір на рожевий, фенолфталеїн у лужному - на малиновий. Універсальний індикаторний папір у лужному середовищі стає синім, у кислому набуває червоного кольору.
Установіть відповідність між речовинами та забарвленням індикаторів:
а)
|
Речовина
1 HCl
2 NaOH
|
Індикатор, забарвлення
А Фенолфталеїн, малиновий
Б Універсальний індикатор, жовтий
В Метиловий оранжевий, рожевий
|
б)
|
Речовина
1 Н2S04
2 Н20
|
Індикатор, забарвлення
А Фенолфталеїн, малиновий
Б Універсальний індикатор, червоний
В Метиловий оранжевий, оранжевий
|
• Які хімічні 'властивості виявляють оксиди, основи, кислоти, солі?
Розгляньмо загальні схеми взаємодії між представниками різних класів неорганічних сполук і конкретні приклади до них.
Кислота + метал → сіль + водень
Н2S04 + Fе = FеS04 + Н2↑
Кислоти у розчинах не реагують із тими металами, які у ряду активності (с. 105, мал. 14.4) розташовані після водню: Н2S04 + Аu →
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
НСІ + Мg→ МgСІ2 + Н2↑
Кислота + основний або амфотерний оксид → сіль + вода
2НNO3 + MgO = Мg(NО3)2 + Н20
2НСl + ВеО = ВеСl2 + Н20
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
НСІ + СuО → СuСІ2 + Н20
Кислота + основа → сіль + вода
2НNОз + Са(ОН)2 = Са(N03)2 + 2Н20
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
Н2S04 + NaОН -> Nа2S04 + Н20
Кислота' + сіль' → сіль" + кислота"
Сильні й нелеткі кислоти витісняють слабкі, леткі, нестійкі кислоти з їхніх солей:
2HN03 + СаС03 = Ca(N03)2 + C02↑ + Н20
H2S + NaCl 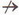
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
HCl + Na2S → NaCl + H2S↑
Луг + кислотний або амфотерний оксид → сіль + вода
2КОН + С02 = К2С03 + Н20
2NaOH + ВеО + Н20 = Na2[Be(OH)4]*
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти, продукти.
NaOH + S03 → Na2S04 + Н20
Луг' + сіль' → основа" + сіль"
Реакція між солями й лугами у розчині відбувається, якщо хоча б одиг з її продуктів - нерозчинна речовина:
2КОН + CuS04 = Cu(OH)2↓+ K2S04
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
Ва(ОН)2 + Na2C03 → NaOH + ВаС03↓
Основний оксид + вода → луг
З водою реагують оксиди металічних елементів ІА і ІІБ (починаючи з Магнію) груп періодичної системи:
СаО + Н20 = Са(ОН)2
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
Li20 + Н20 → LiOH
Кислотний оксид + вода → кислота
SO2 + Н20 = H2S03
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
SO3 + Н20 → H2S04
Пригадайте літній відпочинок на пісковому пляжі й назвіть кислотний оксид, який не реагує з водою. За потреби зверніться до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток).
Основний оксид + кислотний оксид → сіль
МgО + SО3 = МgS04
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
СаО + С02 → СаС03
Сіль' + метал' → сіль" + метал"
Кожний попередній метал (починаючи від магнію) у ряду активності (с.105, мал.14.4) витісняє наступні з розчинів їхніх солей:
CuCl2 + Zп = ZnCl2 + Cu↓
СuСl2 + Аg 
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
СuS04 + Fе → FеS04 + Сu↓
Сіль' + сіль" → сіль"' + сіль""
NaСІ + АgN03 = АgСІ↓ + NaNO3
Завдання
Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти.
МgS04 + ВаСІ2 → ВаS04↓+ МgСІ2
Як представники різних класів неорганічних сполук пов'язані між собою? Розібратися у цьому допоможе малюнок 1.2.
Завдання
Доповніть генетичний ряд кальцію формулою основи.
Са → СаО → ? → СаСІ2
Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій.
Завдання
Доповніть генетичний ряд сірки.
S → ? → Н2SО3 → Nа2S03
Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій.
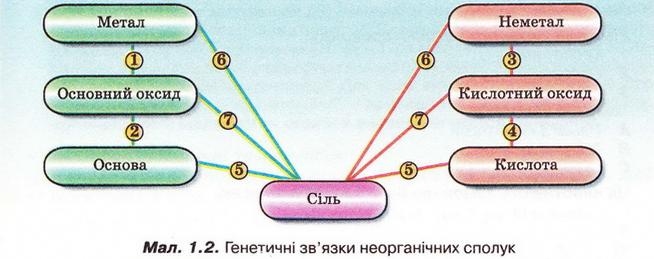
Отже, між класами неорганічних сполук існують зв'язки, які називають генетичними. Генетичний зв'язок полягає у тому, що з речовин одного класу неорганічних сполук можна одержати речовини - представники інших класів. До генетичного ряду речовин входять представники різних класів неорганічних сполук одного й того ж хімічного елемента. Вони мають єдине походження - генезис - і пов'язані взаємоперетвореннями.
Властивості речовин істотно залежать від їхнього хімічного складу. Застосування речовин зумовлене їхніми властивостями.
Встановімо відповідність між складом, властивостями і застосуванням ортофосфатної кислоти.
Ортофосфатна кислота:
1 Одноосновна
2 Трьохосновна
3 Чотирьохосновна
Тому що її молекула містить:
А Один атом Фосфору
В Три атоми Гідрогену
С Чотири атоми Оксигену
Вона реагує з оксидами:
I Основними та амфотерними
II Тільки кислотними
III Основними та кислотними
Тому її застосовують для:
а Підкислення солодких газованих напоїв
b Видалення іржі
Відповідь: 2, В, І, b.
Завдання
Встановіть відповідність між складом, властивостями і застосуванням магній гідроксиду.
Хімічний характер магній гідроксиду:
1 Кислотний
2 Основний
З Амфотерний
Тому що він реагує:
А Тільки з кислотами
В Тільки з лугами
С І з кислотами, і з лугами
Ця властивість зумовила його застосування як:
I Антацидного засобу (проти печії)
II Барвника
III Каталізатора
Отже, ви повторили склад і властивості представників основних класів неорганічних сполук, генетичні зв'язки між ними. Ці знання й уміння луже важливі. Вони знадобляться вам під час вивчення теми «Розчини».
Стисло про головне
Оксиди, основи, кислоти, солі - основні класи неорганічних сполук.
Розчини кислот і лугів можна розрізнити за допомогою індикаторів.
Представники основних класів неорганічних сполук трапляються й у природі, й у побуті. Оксиди, основи, кислоти, солі називають за сучасною науковою номенклатурою. її суть полягає в тому, що кожній сполуці з ід повідає лише одна назва, і навпаки. Назви неорганічних речовин ґрунтуються на українських назвах хімічних елементів.
Оксиди, основи, кислоти, солі класифікують за різними ознаками -якісним і кількісним складом, фізичними та хімічними властивостями. Властивості речовин зумовлені їхнім хімічним складом і будовою.
Між представниками основних класів неорганічних сполук існують генетичні зв'язки. Застосування речовин зумовлене їхніми властивостями.
Застосуйте свої знання й уміння
1. З наведеного переліку виберіть формули речовин, які належать до генетичного ряду магнію: Са, Н20, Мg(N03)2, МgСІ2, S, Н2S04, Na3Р04, 02, Мg(ОН)2, SОз, Мg, МgО.
2. Проаналізуйте хімічні формули речовин з наведених переліків, назвіть їх і класифікуйте:
а) МgSОз, ВаО, Н2S04, Fе(ОН)3, Ва, S03, ВаСІ2, Ва(ОН)2, НВг;
б) S, НN03, ZnСl2, S02, Сu(ОН)2, Na2S03, Н20, Н2S03, LiOН, СаО, НСІ;
в) СuО, Н3РО4, С, Н2С03, С02, Са(ОН)2, К2С03, СuSO4, Fе(ОН)2, НІ;
г) SіО2, К20, Мg(ОН)2, Sі, NaОН, Н2Sі03, Na, АgСІ, К2Sі03, НF, АІ203.
3. Складіть рівняння хімічних реакцій, які відображають генетичні зв'язки літію й вуглецю, та між представниками цих рядів.
Автор Г. А. Лашевська, Хімія, 9 клас
Вислано читачами з інтернет-сайтів
Онлайн бібліотека з підручниками і книгами з хімії, плани-конспекти уроків по всім предметам, завдання з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|

















