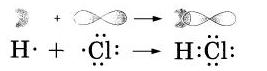|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Степень окисления'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Степень окисления</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Степень окисления'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Степень окисления</metakeywords> |
| | | | |
| - | При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными. | + | При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными. |
| | | | |
| - | <br>Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи: NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:<br> [[Image:him8-51.jpg]] | + | <br>Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной [[Ковалентная_полярная_химическая_связь|химической связи]]: NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:<br> [[Image:Him8-51.jpg|Степень окисления]] |
| | | | |
| - | <br>В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора. | + | <br>В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора. |
| | | | |
| - | <br>Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора: | + | <br>Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком [[45._Будова_електронних_оболонок_атомів_хiмічних_елементів._Поняття_про_радіус_атома|атома]] хлора: |
| | | | |
| - | [[Image:him8-52.jpg]] | + | [[Image:Him8-52.jpg|химия]] |
| | | | |
| | + | <br> |
| | | | |
| | + | При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора: |
| | | | |
| - | При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:
| + | [[Image:Him8-53.jpg|химия]] |
| | | | |
| - | [[Image:him8-53.jpg]]
| + | <br> |
| | | | |
| | + | Такие условные заряды называются ''степенью окисления''. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов. |
| | | | |
| | + | <br><u>''Степень окисления''</u> — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.<br><br>Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:<br>[[Image:Him8-54.jpg|химия]] |
| | | | |
| - | Такие условные заряды называются ''степенью окисления''. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
| + | <br> |
| | | | |
| - | <br><u>''Степень окисления''</u> — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.<br><br>Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:<br>[[Image:him8-54.jpg]]
| + | Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. [[Кислород|Кислород]], второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например: |
| | | | |
| | + | [[Image:Him8-55.jpg|химия]] |
| | | | |
| | + | Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У [[Свойства_черных_и_цветных_металлов|металлов]] главных подгрупп: |
| | | | |
| - | Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород, второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
| + | I группы во всех соединениях степень окисления равна +1,<br>II группы равна +2. III группы — +3, например:<br> |
| | | | |
| - | [[Image:him8-55.jpg]] | + | [[Image:Him8-56.jpg|химия]] |
| | | | |
| - | Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
| + | В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2<br>кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:<br>(+14):2 = +7. |
| | | | |
| - | I группы во всех соединениях степень окисления равна +1,<br>II группы равна +2. III группы — +3, например:<br>
| + | <br>Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов [[Периодическая_система_химических_элементов_Д._И._Менделеева._Полные_уроки|Менделеева]] число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до "заветной восьмерки" 4 электрона и получит при этом степень окисления -4. |
| | | | |
| - | [[Image:him8-56.jpg]]
| + | Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы: |
| | | | |
| - | В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2<br>кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:<br>(+14):2 = +7.
| + | [[Image:Him8-57.jpg|химия]] |
| | | | |
| - | <br>Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до "заветной восьмерки" 4 электрона и получит при этом степень окисления -4. | + | <br>Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение. |
| | | | |
| - | Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
| + | <br>''Названия бинарных соединений'' состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце. |
| | | | |
| - | [[Image:him8-57.jpg]]
| + | <br> |
| | | | |
| - | <br>Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
| + | [[Image:Him8-58.jpg|химия]] |
| | | | |
| - | <br>''Названия бинарных соединений'' состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце. | + | <br> |
| | | | |
| | + | Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной [[Хімія|химии]] (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии. |
| | | | |
| | + | <br>1. Бинарные или двухэлементные, соединения. 2. Степень окисления. 3. Химический номенклатура. |
| | | | |
| - | [[Image:him8-58.jpg]]
| + | <br>Запишите формулы оксидов яэотя (II, V, I. III. IV).<br> |
| | | | |
| | + | [[Image:Him8-59.jpg|химия]] |
| | | | |
| - | | + | <br> <sub>полный [[Гипермаркет знаний - первый в мире!|список тем]] по классам, креативные [[Химия 8 класс|задания для 8 класса]], конспекты для урока [[Химия|химии]]</sub> |
| - | Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
| + | |
| - | | + | |
| - | <br>1. Бинарные или двухэлементные, соединения. 2. Степень окисления. 3. Химический номенклатура.
| + | |
| - | | + | |
| - | <br>Запишите формулы оксидов яэотя (II, V, I. III. IV).<br>
| + | |
| - | | + | |
| - | [[Image:him8-59.jpg]]
| + | |
| - | | + | |
| - | <br> <sub>полный [[Гипермаркет_знаний_-_первый_в_мире!|список тем]] по классам, креативные [[Химия_8_класс|задания для 8 класса]], конспекты для урока [[Химия|химии]]</sub> | + | |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Версия 13:14, 27 июня 2012
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Степень окисления
При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи: NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
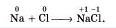
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
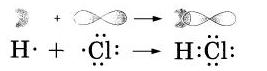
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:

Такие условные заряды называются степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
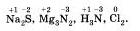
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород, второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
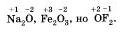
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,
II группы равна +2. III группы — +3, например:

В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2
кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до "заветной восьмерки" 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
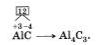
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.

Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
1. Бинарные или двухэлементные, соединения. 2. Степень окисления. 3. Химический номенклатура.
Запишите формулы оксидов яэотя (II, V, I. III. IV).

полный список тем по классам, креативные задания для 8 класса, конспекты для урока химии
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|