|
|
|
| Строка 26: |
Строка 26: |
| | | | |
| | Відповідь. Б.<br> | | Відповідь. Б.<br> |
| | + | |
| | + | [[Image:14_chemistry.jpg]]<br> |
| | + | |
| | + | [[Image:14_1_chemistry.jpg]]<br> |
| | | | |
| | <u>''Завдання''</u><br>1. Виберіть формули речовин із ковалентним зв'язком:<br>А NaCI; Б Н<sub>2</sub>0; В N<sub>2</sub>; Г НВг; Д 0<sub>2</sub>; Ж Вг<sub>2</sub>.<br> | | <u>''Завдання''</u><br>1. Виберіть формули речовин із ковалентним зв'язком:<br>А NaCI; Б Н<sub>2</sub>0; В N<sub>2</sub>; Г НВг; Д 0<sub>2</sub>; Ж Вг<sub>2</sub>.<br> |
| Строка 34: |
Строка 38: |
| | | | |
| | Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку (мал. 2.3).<br> | | Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку (мал. 2.3).<br> |
| | + | |
| | + | [[Image:15_chemistry.jpg]]<br> |
| | | | |
| | <u>''Завдання''</u><br>Виберіть правильне твердження. Під час утворення молекул у хімічних реакціях атоми хімічних елементів намагаються набути стійкої зовнішньої оболонки з:<br>А Шістьох електронів; Б Вісьмох електронів; В Трьох електронів; Г Чотирьох електронів.<br> | | <u>''Завдання''</u><br>Виберіть правильне твердження. Під час утворення молекул у хімічних реакціях атоми хімічних елементів намагаються набути стійкої зовнішньої оболонки з:<br>А Шістьох електронів; Б Вісьмох електронів; В Трьох електронів; Г Чотирьох електронів.<br> |
| Строка 96: |
Строка 102: |
| | | | |
| | Відповідь. А, Б, В. | | Відповідь. А, Б, В. |
| | + | |
| | + | [[Image:16_chemistry.jpg]]<br> |
| | | | |
| | <u>''Завдання''</u> | | <u>''Завдання''</u> |
| Строка 106: |
Строка 114: |
| | | | |
| | Зв'язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.<br>Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільних електронних пар розподілений між ними порівну. Такий зв'язок називають ковалентним неполярним. | | Зв'язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.<br>Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільних електронних пар розподілений між ними порівну. Такий зв'язок називають ковалентним неполярним. |
| | + | |
| | + | [[Image:17_chemistry.jpg]] |
| | | | |
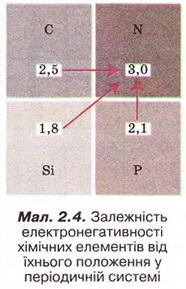
| | ''Електронегативність'' хімічного елемента - це властивість його атома притягувати спільні з іншим атомом електронні пари. Зі зростанням протонного числа електронегативність хімічних елементів зростає у періодах і зменшується у підгрупах. | | ''Електронегативність'' хімічного елемента - це властивість його атома притягувати спільні з іншим атомом електронні пари. Зі зростанням протонного числа електронегативність хімічних елементів зростає у періодах і зменшується у підгрупах. |
| Строка 138: |
Строка 148: |
| | | | |
| | 5. Опишіть зображені на малюнку 2.6 зміни, які відбуваються з йодом за слабкого нагрівання. Зробіть висновок про тип кристалічних ґраток цієї речовини. | | 5. Опишіть зображені на малюнку 2.6 зміни, які відбуваються з йодом за слабкого нагрівання. Зробіть висновок про тип кристалічних ґраток цієї речовини. |
| | + | |
| | + | [[Image:18_chemistry.jpg]] |
| | | | |
| | 6. Спрогнозуйте тип кристалічних ґраток у речовинах за описом їхніх властивостей і застосування: а) камфора (компонент мазей, крапель та інших лікарських форм) - безбарвні леткі кристали з характерним запахом; б) ванілін (ароматизатор кондитерських виробів) - безбарвні, з приємним запахом; в) бор нітрид ВN (боразон) за твердістю наближається до алмазу, водночас стійкіший до високих температур, його використовують для виготовлення надтвердих абразивних матеріалів. | | 6. Спрогнозуйте тип кристалічних ґраток у речовинах за описом їхніх властивостей і застосування: а) камфора (компонент мазей, крапель та інших лікарських форм) - безбарвні леткі кристали з характерним запахом; б) ванілін (ароматизатор кондитерських виробів) - безбарвні, з приємним запахом; в) бор нітрид ВN (боразон) за твердістю наближається до алмазу, водночас стійкіший до високих температур, його використовують для виготовлення надтвердих абразивних матеріалів. |
| Строка 145: |
Строка 157: |
| | <br> | | <br> |
| | | | |
| - | <sub>Збірка конспектів уроків по всім класами, [[Гіпермаркет_Знань_-_перший_в_світі!|домашня робота]], скачати реферати [[Хімія|з хімії]], книги та підручники згідно каленадарного плануванння [[Хімія_9_клас|з хімії для 9 класу]]</sub> | + | <sub>Збірка конспектів уроків по всім класами, [[Гіпермаркет Знань - перший в світі!|домашня робота]], скачати реферати [[Хімія|з хімії]], книги та підручники згідно каленадарного плануванння [[Хімія 9 клас|з хімії для 9 класу]]</sub> |
| | | | |
| | <br> | | <br> |
Версия 15:07, 10 марта 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Хімічний зв’язок і будова речовин
ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИН
Хімічний зв'язок і будова речовин
Аби відповісти на запитання: що називають хімічним зв'язком? Яка його природа? Що таке електронегативність? Як змінюється електронегативність у періодах і групах? Яким чином утворюються ковалентний та йонний зв'язки? Чим відмінні та подібні різні типи хімічного зв'язку? У який спосіб описують внутрішню будову кристалів? Для чого використовують знання про хімічний зв'язок і будову речовини? - пригадайте курс хімії 8-го класу, проаналізуйте малюнки та схеми й виконайте тестові завдання.
Виберімо правильні твердження.
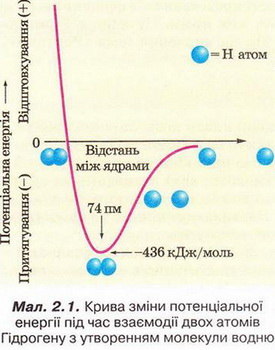
Для утворення хімічного зв'язку між двома атомами необхідно, щоб енергія системи з двох атомів:
А Була нижчою за енергію окремо взятих атомів; Б Була вищою за енергію окремо взятих атомів; В Дорівнювала енергії окремо взятих атомів; Г Була б спочатку нижчою, а згодом - вищою за енергію окремо взятих атомів.
Відповідь. А.
Ковалентним зв'язком сполучені атоми:
А Металічних елементів; Б Неметалічних і металічних елементів; В Неметалічних елементів; Г Інертних елементів.
Відповідь. В.
Йонним зв'язком сполучені атоми:
А Металічних елементів; Б Неметалічних і металічних елементів; В Неметалічних елементів; Г Лужних елементів.
Відповідь. Б.
Завдання
1. Виберіть формули речовин із ковалентним зв'язком:
А NaCI; Б Н20; В N2; Г НВг; Д 02; Ж Вг2.
2. Виберіть формули речовин із ковалентним полярним зв'язком:
А KCl; Б S02; В 03; Г НІ; Д І2; Ж СаВг2.
3. Виберіть формули речовин із ковалентним неполярним зв'язком:
А Н20; Б 02; В CF4; Г СІ2; Д NH3; Ж 03.
Під час утворення молекул у хімічних реакціях атоми хімічних елементів прагнуть утворити стійку зовнішню оболонку (мал. 2.3).
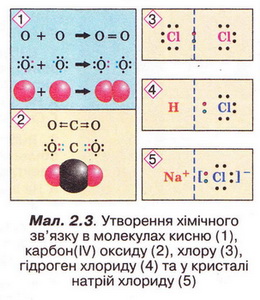
Завдання
Виберіть правильне твердження. Під час утворення молекул у хімічних реакціях атоми хімічних елементів намагаються набути стійкої зовнішньої оболонки з:
А Шістьох електронів; Б Вісьмох електронів; В Трьох електронів; Г Чотирьох електронів.
Завдання
Встановіть відповідність між назвами речовин і типами хімічного зв'язку у них:
|
Назва речовини
1 Кисень
2 Карбон(ІV) оксид
|
Тип хімічного зв'язку
А Ковалентний неполярний
Б Ковалентний полярний
В Йонний
|
Завдання
Встановіть відповідність між типами хімічного зв'язку у бінарних сполуках і хімічними елементами, які входять до їхнього складу:
|
Тип хімічного зв'язку
1 Ковалентний неполярний
2 Ковалентний полярний
3 Йонний
|
Елементи у складі бінарної сполуки, їхня електронегативність
А Неметалічні, однакова
Б Неметалічні, різна
В Металічний і неметалічний
Г Металічні, однакова
|
Електронегативність хімічного елемента — це властивість його атома притягувати спільні з іншим атомом електронні пари.
Завдання
1. Виберіть правильне твердження. У підгрупах зі збільшенням протонних чисел електронегативність елементів:
А Не змінюється; Б Збільшується; В Зменшується; Г Спочатку збільшується, потім зменшується.
2. Виберіть правильне твердження. У періодах зі збільшенням кількості електронів в атомах електронегативність елементів:
А Не змінюється; Б Збільшується; В Зменшується; Г Спочатку зменшується, потім збільшується.
3. Розташуйхе хімічні елементи за зростанням їхньої електронегативності:
А С, Б О, В Sі, Г F
4. Розташуйте хімічні елементи за зменшенням їхньої електронегативності:
А Са; Б Al; В Sі; Г К.
5. Виберіть правильні записи (х - електронегативність):
А х(Н) < х(Сl); Б х(Н) > х(О); В х(F < х(Вг); Г х(N) > х(Н); Д х(Н) < х(С).
Виберімо характеристику речовин з йонними кристалічними ґратками:
А Високі температури плавлення; Б Низькі температури кипіння; В Молекули у вузлах кристалічних ґраток; Г Різкий запах.
Відповідь, А.
Виберімо характеристики речовин з молекулярними кристалічними ґратками:
А Невисокі температури плавлення; Б Невисокі температури кипіння; В Молекули у вузлах кристалічних ґраток; Г Висока твердість; Д Атоми у вузлах кристалічних ґраток.
Відповідь. А, Б, В.
Завдання
Виберіть характеристики речовин з атомними кристалічними ґратками:
А Невисокі температури плавлення; б Не розчиняються у воді; В Йони у вузлах кристалічних ґраток; Г Висока твердість; Д Приємний запах.
Стисло про головне
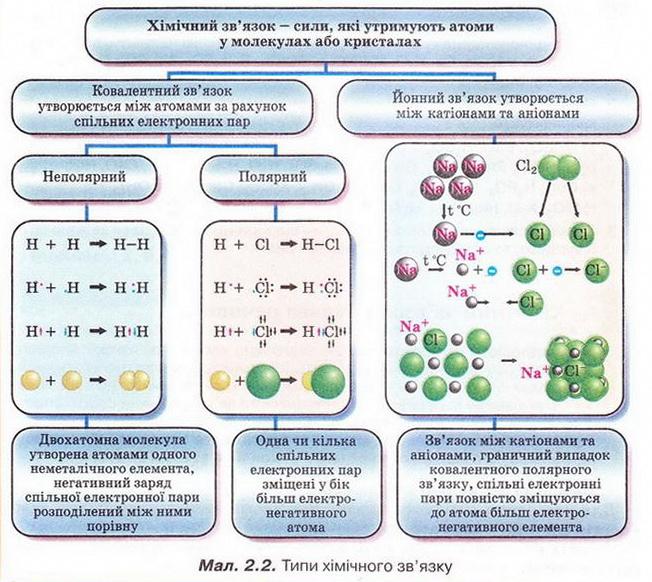
Хімічним зв'язком називають сили, які утримують атоми в молекулах або кристалах. Він має електронну природу.
Зв'язок між атомами за рахунок спільних електронних пар називають ковалентним. Його зображують за допомогою електронних і графічних формул молекул.
Якщо двохатомна молекула утворена атомами одного неметалічного елемента, то негативний заряд спільних електронних пар розподілений між ними порівну. Такий зв'язок називають ковалентним неполярним.
Електронегативність хімічного елемента - це властивість його атома притягувати спільні з іншим атомом електронні пари. Зі зростанням протонного числа електронегативність хімічних елементів зростає у періодах і зменшується у підгрупах.
Ковалентний зв'язок, у якому одна чи кілька спільних електронних гар зміщені у бік більш електронегативного атома, називають полярним зв’язком.
Йонний зв'язок - це зв'язок між катіонами та аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв'язку. Якщо різниця в електронегативності атомів хімічних елементів дуже велика, спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони, завершуючи у такий спосіб зовнішній енергетичний рівень.
Межа між ковалентним полярним та йонним зв'язком дещо умовна. Різниця електронегативностей хімічних елементів дає змогу визначити, і в : кільки хімічний зв'язок у сполуці відрізняється від чисто ковалентного.
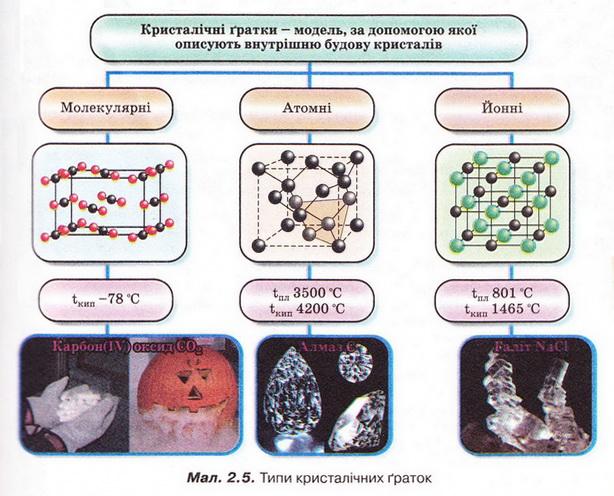
Кристалічні ґратки - модель, за допомогою якої описують знутрішню будову кристалів. Точки кристалічних ґраток, у яких розташовані частинки, називають вузлами кристалічних ґраток. Природа частинок у вузлах кристалічних ґраток та сили взаємодії між частинками визначають тип ґраток: йонні, атомні, молекулярні.
Молекулярні речовини мають низькі температури плавлення й кипіння, адже молекули слабко зв'язані між собою. Речовини, що маютьатомні кристалічні гратки, плавляться за високих температур, практично нерозчинні у будь-яких розчинниках, мають низьку реакційну здатність. У йонних кристалах зв’язки між йонами міцні, тому такі кристали зазвичай мають високі температури плавлення. Вони тверді, але крихкі.
Властивості сполук залежать від їхньої будови і зумовлюють застосування речовин.
Застосуйте свої знання й уміння
1. Виберіть хімічний елемент, атоми якого під час утворення молекул у хімічних реакціях намагаються набути стійкої зовнішньої оболонки з двох електронів:
1 Хлор; 2 Натрій; 3 Гідроген; 3 Карбон.
2. У молекулі брому тип хімічного зв’язку:
1 Ковалентний неполярний; 2 Ковалентний полярний; 3 Йонний.
Він утворений за рахунок:
А Однієї спільної електронної пари; Б Двох спільних електронних пар; В Трьох спільних електронних пар; Г Чотирьох спільних електронних пар.
3. У молекулі гідроген сульфіду тип хімічного зв’язку:
1 Ковалентний неполярний; 2 Ковалентний полярний; 3 Йонний.
Він утворений за рахунок:
А Однієї спільної електронної пари; Б Двох спільних електронних пар; в Переходу електрона від атома Сульфуру до атома Гідрогену; Г Зміщення електрона від атома Сульфуру до атома Гідрогену.
4. У кристалічних ґратках алмазу містяться:
1 Йони; 2 Молекули; 3 Атоми.
Вони зв’язані між собою:
А Ковалентними зв’язками; Б Електростатичними силами
5. Опишіть зображені на малюнку 2.6 зміни, які відбуваються з йодом за слабкого нагрівання. Зробіть висновок про тип кристалічних ґраток цієї речовини.

6. Спрогнозуйте тип кристалічних ґраток у речовинах за описом їхніх властивостей і застосування: а) камфора (компонент мазей, крапель та інших лікарських форм) - безбарвні леткі кристали з характерним запахом; б) ванілін (ароматизатор кондитерських виробів) - безбарвні, з приємним запахом; в) бор нітрид ВN (боразон) за твердістю наближається до алмазу, водночас стійкіший до високих температур, його використовують для виготовлення надтвердих абразивних матеріалів.
7. Обчисліть об'єм газу (н. у.), який утвориться під час сублімації сухого льоду (карбон(ІV) оксиду) масою 220 г.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
















