|
Гіпермаркет Знань>>Фізика і астрономія>>Фізика 9 клас>> Атом і атомне ядро. Дослід Резерфорда. Ядерна модель атома
АТОМ І АТОМНЕ ЯДРО
Без сумніву, багато хто з вас восени 2008 р. чув про запуск найпотужнішої фізичної установки сучасності — великого адронного колайдера (рис. 31.1).
Рис. 31.1. Великий андронний колайдер.
Витрати на його створення були величезними: Німеччина, Франція, Японія мусили об'єднати свої зусилля, щоб побудувати це диво техніки. А почався процес вкладання «великих коштів» у фізику ще в 40-х рр. минулого століття, коли вчені винайшли способи розщеплення атомного ядра.
Про те, навіщо розщеплювати атомні ядра і чому уряди різних країн у великих обсягах фінансують досліджування першооснови матерії, ви дізнаєтеся з цього параграфа.
Дізнаємося про ядерну фізику
Історія фізичної науки налічує майже 2500 років, але тільки минулого століття фізики перетворилися з поважних викладачів та кабінетних учених на консультантів урядів. Кількість фахівців-фізиків збільшилася в сотні разів, були створені величезні заводи для виробництва фізичних приладів і обладнання. І сталося це передусім завдяки успіхам ядерної фізики.
Ядерна фізика — це розділ фізики, який вивчає структуру і властивості атомного ядра, процеси, що в ньому відбуваються, та механізми його перетворень.
Результати ВТІЛИЛИСЯ сьогодні її пилісу тик знн-пих радіаційних технологій, які знетоеовують у медицині, геології, сільському господарстві та в інших галузях. Проте найважливіша сфера застосування досягнень ядерної фізики — отримання енергії. За короткий проміжок часу в розвинутих країнах світу частка електричної енергії, що одержують за рахунок розщеплення атомних ядер, стала дорівнювати десяткам відсотків, а в деяких країнах, у тому числі в Україні, сягнула половини загального видобутку енергії.
Стрімкий розвиток ядерної енергетики пов'язаний з високою ефективністю ядерного «палива». Наведемо такий приклад. Для забезпечення безперервної роботи протягом доби звичайної електричної лампи потужністю 100 Вт необхідно понад 8,6 МДж енергії. Щоб отримати цю енергію на гідроелектростанції, необхідно, щоб на гідротурбіну надійшло приблизно 120 т води, щоб отримати її на тепловій електростанції, треба спалити десь 1 кг вугілля. А щоб ту саму енергію одержати на АЕС, слід взяти порошинку урану масою лише 0,3 мг і розщепити ядра її атомів. Погодьтеся, що різниця вражаюча.
На думку фізиків, коли будуть розгадані таємниці будови мікрочастинок, які входять до складу ядра, відкриються ще більші можливості. Саме тому уряди різних держав активно підтримують фундаментальні наукові дослідження в галузі ядерної фізики.
Згадуємо будову атома та атомного ядра
Перед тим як розпочати безпосереднє вивчення матеріалу розділу, згадаємо будову атома. Відомо, що атом складається з ядра та електронної хмари навколо. Ядро, у свою чергу, містить частинки двох видів: протони, які мають позитивний електричний заряд, і нейтрони — частинки, які не мають заряду*. Маса протона приблизно дорівнює масі нейтрона і майже у 2000 разів більша за масу електрона. Протони й нейтрони, що входять до складу ядра атома, називають нуклонами. Сумарну кількість протонів і нейтронів в атомі називають нуклонним (або масовим) числом та позначають символом А.
Атом є електронейтральним, тобто сумарний заряд протонів, що містяться у ядрі, дорівнює сумарному заряду електронів, що обертаються навколо ядра. А оскільки заряд протона за модулем дорівнює заряду електрона, то зрозуміло, що в атомі кількість протонів дорівнює кількості електронів.
Кількість протонів у ядрі називають протонним (або зарядовим) числом та позначають символом 2. Його легко визначити, скориставшись Періодичною системою хімічних елементів Д. І. Менделєєва. Порядковий номер елемента у періодичній таблиці відповідає кількості протонів у ядрі (протонному числу).
* Уперше припущення про протонно-нейтронну будову ядра атома висловив у 1932 р. радянський учений (уродженець Полтавщини) Д. Д. Іваненко. У тому ж році на основі даного припущення німецький учений В. Гейзенберґ побудував теорію атомного ядра.
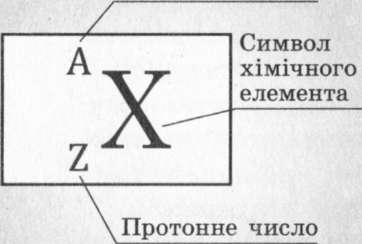
Рис. 31.2. Позначення ядра атома.
Знаючи протонне (2) і нуклонне (А) числа ядра хімічного елемента, можна визначити кількість нейтронів (./V) у ядрі цього елемента: ^=А-2.
При позначенні ядра атома хімічного елемента перед символом елемента вверху вказується нуклонне число А, а внизу — протонне число 2 (рис. 31.2).Наприклад, ^АІ — ядро Алюмінію, що має нуклонне число 27 та протонне число 13. Цей запис означає, що в ядрі атома Алюмінію міститься 27 нуклонів: 13 протонів і 27-13 = 14 нейтронів.
Слід звернути увагу на те, що ядра атомів того самого хімічного елемента можуть відрізнятися кількістю нуклонів. З курсу хімії ви знаєте, що різновиди даного хімічного елемента, атоми яких мають у своїх ядрах однакову кількість протонів, але різну кількість нейтронів, називають ізотопами даного хімічного елемента. Наприклад, ядро Торію-234 (2дцТЬ) містить 234 нуклони: 90 протонів і 144 нейтрони, а ядро Торію-230 містить 230 нуклонів: 90 протонів і 140 нейтронів.
Хоча в ядрі зосереджена майже вся маса атома, розмір ядра у порівнянні з атомом надзвичайно малий (приблизно розмір атома становить 10~10 м, а ядра — 10 15 м). Уявіть, що вдалося збільшити атом до розміру великого стадіону. Розмір ядра такого атома теж зросте. Наскільки? Обчислення показують, що в цьому випадку діаметр ядра атома приблизно дорівнюватиме розміру мурахи, що повзе по траві стадіону.
Дізнаємося про класичний дослід Резерфорда
Факти про будову атома, перелічені вище, вам уже відомі з курсів хімії та природознавства. Але як саме вчені дізналися про будову атома, адже він має такі малі розміри?
У 1908-1911 рр. досвідченим дослідником Гансом Ґейґером (1882-1945) та молодим аспирантом Ернестом Марсденом (1889-1970) під керівництвом англійського фізика Ернеста Резерфорда (рис. 31.3)

Рис. 31.3. Ернест Розерфорд.
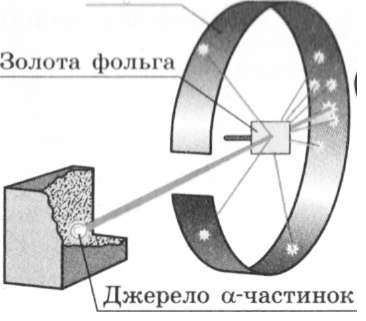
було здійснено серію дослідів, схему яких наведено на рис. 31.4.
Рис. 31.5. Схема дослідів Розенфорда.
Для дослідів учені використали речовину, із якої з великою швидкістю вилітали позитивно заряджені частинки (тик звані її (нлм|ш) частинки).
ром, отримали вузький пучок а-частинок, який спрямовували на тонку золоту фольгу. Пристрій містив також екран, покритий спеціальною речовиною. Якщо в такий екран улучала а-частинка, то в місці її влучання відбувався слабкий спалах світла. Учені спостерігали спалахи за допомогою мікроскопа і реєстрували попадання в екран кожної а-частинки.
У результаті дослідів було з'ясовано, що переважна більшість а-частинок проходить крізь золоту фольгу, причому деякі з них відхиляються від початкової траєкторії. А от приблизно одна з 20000 частинок відскакує назад, начебто натикається на якусь перешкоду у фользі (рис. 31.5). Останнє виявилось найбільш вражаючим для вчених.
Зрозуміло, що Е. Резерфорд не міг бачити внутрішню структуру атома, тому він залучив логіку. Якщо позитивний заряд і маса рівномірно розподілені по всьому об'єму атома (а саме таке уявлення про атом існувало на той час у фізиці), то всі а-частинки повинні пролетіти крізь фольгу, практично не відхиляючись, адже їхня енергія колосальна. Приблизно так буде, якщо з гармати стріляти впритул у копицю сіна або кидати м'ячик через павутиння.
Якщо ж позитивний заряд і маса зосереджені у невеликому об'ємі всередині атома, а навколишнім простором є «порожнеча», то бомбардування а-частинками нагадуватиме кидки здалеку тенісним м'ячиком у металеву банку, закріплену на жердині. Тільки в мізерній кількості випадків м'ячик відскочить від банки й повернеться до того, хто кидав, у решті ж спроб він пролетить повз ціль. Як ви бачите, другий варіант значно більше підходить для пояснення результатів експерименту.
Логічні розмірковування й дані експериментів практично збігаються, якщо вважати, що вся маса атома зосереджена у важкому позитивно зарядженому ядрі, розмір якого у 100 000 разів менший, ніж розмір самого атома.
Тому після зазначених дослідів Резерфорд у 1911 р. висунув ядерну модель будови атома. Згідно з цією моделлю атом складається з позитивно зарядженого ядра, оточеного негативно зарядженими частинками — електронами. При цьому ядро займає лише невеликий об'єм усередині атома, але в ньому зосереджена мало не вся маса атома. Електронна оболонка займає майже весь об'єм атома, але її маса є незначною порівняно з масою атома.
Дізнаємося про сильну взаємодію
Вам уже відомо, що електрони, маючи негативний заряд, утримуються навколо позитивного ядра завдяки електромагнітній взаємодії. Але яким чином у складі одного ядра і на дуже близькій відстані один від одного утримуються протони, адже однойменно заряджені частинки відштовхуються?
Фізики з'ясували, що всі частинки всередині ядра притягуються одна до одної, причому байдуже які: протон до протона, протон до нейтрона, нейтрон до нейтрона. І це відбувається завдяки взаємодії іншого виду, яка набагато сильніша, ніж електромагнітне відштовхування протонів. Саме тому взаємодію нуклонів називають сильною взаємодією.
Підбиваємо підсумки
Сьогодні суспільна значущість ядерної фізики полягає в можливості забезпечити людство високоефективними джерелами енергії на тривалий період.
У результаті дослідів, проведених під керівництвом Е. Резерфорда, було висунуто ядерну модель будови атома, згідно з якою атом містить позитивно заряджене важке ядро, що займає невеликий об'єм усередині атома, і негативно заряджені електрони. При цьому електронна хмара займає майже весь об'єм атома, але її маса є незначною порівняно з масою атома.
Ядра атомів складаються з нуклонів — протонів і нейтронів. Кількість протонів у ядрі атома даного елемента дорівнює порядковому номеру цього елемента в періодичній системі хімічних елементів. Різновиди даного хімічного елемента, атоми яких мають у своїх ядрах однакову кількість протонів, але різну кількість нейтронів, називають ізотопами цього хімічного елемента. У ядрі нуклони втримуються разом завдяки сильній взаємодії, яка значно сильніша за електромагнітну.
При позначенні ядра атома будь-якого хімічного елемента перед символом елемента вказують значення нуклонного числа а та протонного числа 2.
Фізика 9 клас. Ф.Я.Божинова, М.М.Кірюхін О.О.Кірюхіна
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|