|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Білки: склад і будова. Гідроліз, денатурація, кольорові реакції білків. Біологічна роль амінокислот і білків
БІЛКИ: СКЛАД І БУДОВА. ГІДРОЛІЗ, ДЕНАТУРАЦІЯ, КОЛЬОРОВІ РЕАКЦІЇ БІЛКІВ. БІОЛОГІЧНА РОЛЬ АМІНОКИСЛОТ І БІЛКІВ
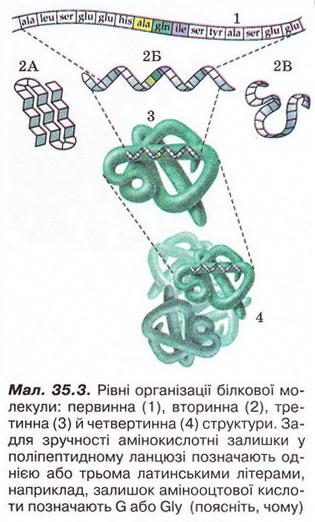
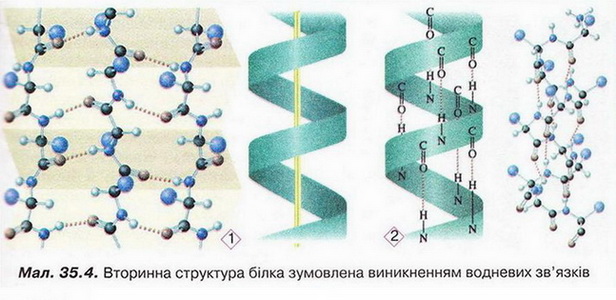
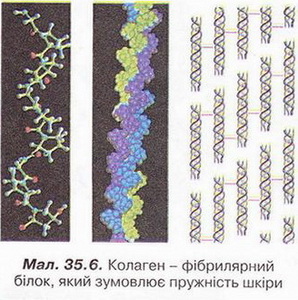
Білки Після опрацювання § 35 ви зможете: Характеризувати склад, структуру, фізичні та хімічні властивості білків, їхню первинну, вторинну, третинну й четвертинну структуру; визначати білки дослідним шляхом; обгрунтовувати застосування білків їхніми властивостями, роль у живому організмі; встановлювати причинно-наслідкові зв’язки між складом, будовою, властивостями та біологічними функціями і застосуванням білків; висловлювати судження щодо значення білків у суспільному господарстві, побуті, охороні здоров'я тощо. На шляху до успіху пригадаємо з курсів хімії, біології, основ здоров'я: що таке гідроліз; як утворюються поліпептиди; чим відрізняється теорія від гіпотези, аналіз - від синтезу; що таке біосинтез; що таке ферменти; у чому відмінність між оборотними і необоротними процесами; як утворюється водневий зв'язок і яке значення він має; що таке гідратна оболонка; чим зумовлені хімічні й термічні опіки і якої першої допомоги вони потребують; як пов'язані харчування і здоров'я; які вимоги до харчування підлітків. • Чому білки? Назва «білки» походить від відомого з давніх-давен яєчного білка (лат. albumen), який унаслідок нагрівання перетворюється, на білу нерозчинну масу. Згідно з описами Плінія Старшого, уже в Стародавньому Римі яєчний білок застосовували як лікувальний засіб. Однак справжня історія білкових речовин розпочалася тоді, коли з’явилися відомості про хімічні властивості білків. Найважливіша з-поміж них - здатність до гідролізу. • Гідроліз білків - реакція, за допомогою якої з них було добуто амінокислоти. Ви звичайно, пам'ятаєте, що саме в такий спосіб відкрито й найпростішу з них - амінооцтову. Унаслідок гідролізу руйнуються пептидні зв'язки між амінокислотними залишками. Тобто реакція гіддролізу білків обернена до реакції їхнього утворення з амінокислот. Виявлення амінокислот у продуктах гідролізу білків мало вирішальне значення для розуміння хімічної природи білкових полімерів. • Склад і будову білків науковці намагалися означити чи не з XVII ст. Крок за кроком просувалися вони до мети - створення теорії будови білка. Зокрема, думку про амінокислотний склад білків висловлював І. Я. Горбачевський (мал. 35.1). Він одним з перших виділив у чистому вигляді амінокислоти і попалав, що вони є «будівельними цеглинками» білків. Зрештою в 1902 р. Е. Фішер (мал. 35.2) сформулював пептидну гіпотезу, згідно з якою білки побудовані з амінокислотних залишків, з'єднаних пептидними зв'язками. Він висловив припущення, що амінокислоти, які утворюються внаслідок гідролізу білків, є для них найпростішим «будівельним матеріалом». Науковець експериментально довів, що амінокислоти сполучаються між собою в результаті взаємодії карбоксильних і аміногруп з виділенням води та утворенням поліпептидів. Він започаткував синтез поліпептидів і одержав білкову речовину з відносною молекулярною масою 1213 - першу синтетичну сполуку, подібну до найпростіших білків. Отже, пептидну гіпотезу було повністю підтверджено аналізом білків і синтезом їх з амінокислот. Таким чином, подальше вивчення будови білків дістало міцне теоретичне підґрунтя. • Рівні організації білкової молекули - її первинна, вторинна, третинна й четвертинна структури (мал. 35.3). Цю класифікацію запропонував у 1952 р. датський біохімік К.У. Ліндерштрем-Ланг. Вона актуальна й дотепер, У живих організмах амінокислотний склад білків визначається генетичним кодом. З двадцяти а-амінокислот (у їхніх молекулах карбоксильна й аміногрупа сполучені з одним і тим самим атомом Карбону, як, наприклад, у гліцині) утворюються поліпептидні ланцюги найрізноманітнішого складу й будови. Кількість амінокислотних залишків у молекулах окремих білків різна. Приміром, в інсуліні їх 51, у міоглобіні - близько 140. Тому и відносна молекулярна маса білків коливається в дуже широких межах Наприклад, в інсуліні вона становить близько 6500, а в білка вірусу грипу - 320 000 000. Первинна структура - послідовність амінокислотних залишків поліпептидному ланцюзі. Виявлено, що певна комбінація амінокислот зумовлює специфічні функції білка в організмі. Тож за первинною структурою можна передбачити функції невідомого білка. Або, навпаки синтезувати білкову речовину з потрібними функціями. Первинні структура білка виникає внаслідок утворення пептидних зв'язків мін: амінокислотними залишками. Вторинна структура - місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків (мал. 35.4). Яке полярні групи фрагментів первинної структури віддалені одна від одно: утворюються складчасті шари (мал. 35.3, 2А; 35.4,1) з кількох зигзагуватих поліпептидних ланцюгів. Якщо ж полярні групи фрагментів первинної структури розташовані близько, утворюється так звана а-спіраль (мал. 35.3,2.Б; 35.4,2), один виток якої містить чотири амінокислотні залишки. Уперше таку структуру виявив Лайнус Лолінг (мал. 35.5) під час вивчення методом рентгеноструктурного аналізу головного білка волосся й вовни - а-кератину. її назвали а-структурою, або а-спіраллю. Також можливе утворення клубка біополімеру іншої форми (мал. 35.3, 2В). Третинна структура - просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Неабияку роль у виникненні й підтриманні третинної структури відіграють електростатичні сили притягання й відштовхування та водневі зв'язки. Четвертинна структура зумовлена взаємним розташуванням кількох поліпептидних ланцюгів у складі єдиного білкового комплексу (мал. 35.3,4). Гемоглобін - перший білок, в якого було виявлено четвертинну структуру. Цікаво? Четвертинна структура гемоглобіну складається з чотирьох макромолекул. Вони утворюють надмолекулярну структуру сферичної форми. її функція - транспортування кисню в живих організмах. Пізнавально! • Чи розчинні білки? Це залежить від їхньої будови: саме просторова структура білка визначає його властивості й біологічні функції. У молекулах глобулярних білків поліпептидні ланцюги згорнуті в щільні кулясті структури - глобули. До глобулярних білків належать ферменти, антитіла, деякі гормони тощо. Чимало глобулярних білків - водорозчинні, зокрема альбуміни, - прості глобулярні білки, які містяться в яєчному білку, сироватці крові, молоці й насінні рослин. Білки, що входять до складу покривних тканин і утворень, - фібрилярні (мал. 35.6). Вони погано розчинні або нерозчинні у воді. Це білки м'язових тканин, шкірних рогових покривів, вовни й пір'я тощо. • Осадження білків відбувається під впливом різноманітних органічних і неорганічних речовин - етанолу, солей, концентрованих кислот. Аби пересвідчитися в цьому, виконаймо досліди. У пробірки з водним розчином альбуміну добавимо насичені водні розчини солей лужних і лужноземельних елементів, наприклад натрій хлориду й магній сульфату. Внаслідок цього руйнується гідратна оболонка частинок білка й утворюється осад, який знову можна розчинити у воді. Важливо, що за такого осадження й розчинення властивості білків відновлюються, вони не втрачають, наприклад, ферментативної активності. У такий спосіб очищають білки, одержують їх у кристалічному вигляді. Органічні розчинники, наприклад етанол, також спричиняють дегідратацію білкових макромолекул, руйнують їхні водні оболонки. Осадження білків спиртом оборотне, якщо процес відбувався без нагрівання й вплив реагенту був короткочасним. Тривалий контакт білка зі спиртом призводить до необоротного осадження - денатурації. • Денатурація білка пов'язана з глибокими внутрішньомолекулярними змінами його будови, руйнуванням четвертинної, третинної і вторинної структур. Це призводить до втрати білком розчинності, біологічної активності тощо. Деякі чинники, які зумовлюють денатурацію білків, наведені в таблиці 35.1. Таблиця 35.1
Приміром, денатурація білків відбувається у сильнокислому середовищі шлунка. Це сприяє ферментативному розщепленню білків під час перетравлювання їжі. Хімічні опіки шкіри й слизових оболонок також зумовлені денатурацією білків під впливом їдких речовин. Термічні опіки - приклад денатурації білків за високої температури. Денатурацію білків застосовують для лікування отруєння сполуками важких металічних елементів: Купруму, Плюмбуму тощо. Хворому дають молоко або сирі яйця. Токсичні сполуки денатурують білки молока або яєць й поглинаються їхньою поверхнею. • Чи оборотна денатурація? У пробірці (in vitro) денатурація, найчастіше - необоротний процес. Якщо ж денатурований білок помістити в умови, близькі до природних, то він може відновити свої властивості, але дуже повільно (таке явище властиве не всім білкам). • Кольорові реакції білків застосовують для виявлення цих сполук поміж інших органічних речовин. Виконайте лабораторний дослід, аби пересвідчитися в цьому. ЛАБОРАТОРНИЙ ДОСЛІД Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ № 14. Кольорові реакції білків Завдання Виконайте ксантопротеїнову й біуретову (мал. 35.7) реакції, опишіть ознаки їхнього перебігу. Обладнання: штатив з пробірками або пластина із заглибинами, пробіркотримач. Реактиви: розчини нітратної кислоти, купрум(ІІ) сульфату, натрій гідроксиду, яєчного білка. Інструкція Дослід 1. Взаємодія розчину білка з нітратною кислотою (ксантопротеїнова реакція). У пробірку внесіть по 5 крапель розчинів білка та нітратної кислоти. Нагрійте добутий білий осад до появи жовтого забарвлення. Дослід 2. Взаємодія розчину білка з купрум(ІІ) гідроксидом (біуретова реакція). У пробірку (або заглибину пластини) внесіть 5 крапель розчину білка, добавте 2 краплі розчину купрум(ІІ) сульфату. Далі добавляйте розчин натрій гідроксиду до утворення фіолетового розчину. • Біологічна роль амінокислот і білків дуже важлива. Білки - невід'ємні складові всіх живих організмів. Вони беруть участь чи не в кожному внутрішньому процесі клітини. Білки - важлива частина харчування людини і тварин, оскільки їхні організми не можуть синтезувати всі необхідні амінокислоти й частина з них надходить із білковою їжею. Під час травлення ферменти руйнують спожиті білки до амінокислот, які організм використовує для біосинтезу властивих йому білків або для одержання енергії. Чимало біологічно активних сполук - речовини білкової природи. Докладно функції білків і значення амінокислот у життєдіяльності організмів ви вивчатимете на уроках біології. Стисло про головне Білки - високомолекулярні органічні сполуки, які складаються зі сполучених у ланцюг амінокислотних залишків. Унаслідок гідролізу руйнуються пептидні зв'язки між амінокислотними залишками. Реакція гідролізу білків обернена до реакції їхнього утворення з амінокислот. Рівні організації білкової молекули - її первинна, вторинна, третинна й четвертинна структури. Первинна структура - послідовність амінокислотних залишків у поліпептидному ланцюзі. Первинна структура білка виникає внаслідок утворення пептидних зв'язків між амінокислотними залишками. Вторинна структура - місцеве впорядкування фрагмента поліпептидного ланцюга внаслідок утворення водневих зв'язків. Третинна структура - просторова будова поліпептидного ланцюга, зумовлена взаємним розташуванням елементів вторинної структури. Третинна структура стабілізована насамперед ковалентними зв'язками, які виникають унаслідок взаємодії між функціональними групами різної хімічної природи. Четвертинна структура зумовлена взаємним розташуванням кількох поліпептидних ланцюгів у складі єдиного білкового. Просторова структура білка визначає його властивості й біологічні функції. Глобулярні білки здебільшого розчинні, фібрилярні - ні. Осадження білків солями Натрію, Магнію - оборотний процес. Осадження білків спиртом оборотне, якщо процес відбувався без нагрівання й вплив реагенту був короткочасним. Тривалий контакт білка зі спиртом призводить до необоротного осадження, денатурації. Денатурація білка пов'язана з глибокими внутрішньомолекулярними змінами його будови, руйнуванням четвертинної, третинної й вторинної структур. У пробірці (in vitro) денатурація найчастіше - необоротний процес. Якщо ж денатурований білок помістити в умови, близькі до природних, то він може відновити свої властивості, але дуже повільно (таке явище властиве не всім білкам). Кольорові реакції білків (ксантопротеїнову й біуретову) застосовують для виявлення цих сполук поміж інших органічних речовин. Цікаво? В Україні до культу родючості з давніх часів належить звичай розмальовувати курячі або декоративні яйця - писанки. Писанка багата символічними образами. Кожний регіон України має свої особливості у визначенні кольорів та орнаментів, тобто свою власну символіку. У християнську добу всі ці символічні мотиви пов 'язувалися з Великоднем. Застосуйте свої знання й уміння 1. Назвіть відомі вам біополімери. 2. Поясніть суть реакції гідролізу білків та її значення. 3. Схарактеризуйте структурні рівні організації молекули білка. 4. Поясніть, чому альбумін розчиняється у воді, а колаген - ні. 5. Наведіть приклади денатурації білків і поясніть суть цього процесу. 6. З огляду на вивчене поясніть згубну дію алкоголю та радіоактивного опромінення на здоров'я. 7. Поясніть, чому інколи молоко під час кип'ятіння зсідається. Звідки в молоці з'являються речовини, які зумовлюють це явище? 8. Поміркуйте, чому досвідчені господині для одержання смачного бульйону м'ясо кладуть у холодну воду, а для приготування смачного м'яса - в окріп. Здійсніть експериментальну перевірку власних міркувань, опишіть методику проведення експерименту й спостереження. Чи підтвердилися ваші гіпотези щодо причин такого підходу до приготування страв? 9. Поясніть, для чого у лабораторіях медичних закладів під час аналізу сечі здійснюють біуретову реакцію. 10. Схарактеризуйте значення білків у суспільному господарстві, побуті, охороні здоров'я тощо. Скарбничка досвіду 1. В одноразовий пластиковий стакан налийте молоко об'ємом 50 мл, розбавте його вдвічі водою і добавте столовий оцет об'ємом 1 мл (замість оцту можна використати розчин лимонної кислоти або сік цитрини). Трохи нагрійте цю суміш. Опишіть спостереження. Запропонуйте спосіб попередньої перевірки молока на наявність речовин, які спричиняють його згортання. Поясніть, для чого недобросовісні продавці в місцях стихійної торгівлі добавляють у молоко питну соду, антибіотики. Спрогнозуйте наслідки споживання порівняно дешевого молока, яке не пройшло санітарного контролю. Оцініть доцільність покупок у місцях стихійної торгівлі. 2. Приготуйте два однакові клаптики накрохмаленої сухої марлі завбільшки з долоню, блюдце з розбавленим розчином йоду, склянку з водою, сірники (без головки) з намотаними на кінцях жмутиками вати (або так звані ватні палички промислового виробництва). Добре змочіть слиною вату на одному сірнику і посередині клаптя накрохмаленої марлі напишіть літеру. Затисніть марлю між долонями й тримайте так 2-3 хв, а потім змочіть розчином йоду. Спостерігайте, як забарвлюється клаптик марлі. Повторіть ці дії, але замість слини змочіть вату на другому сірникові водою. Опишіть спостереження, порівняйте і поясніть результати дослідів. 3. Під керівництвом учителя дослідіть, чи відбувається біуретова реакція з: а) натуральним м'ясним бульйоном; б) бульйонами з бульйонних кубиків різних виробників; в) овочевим відваром. Зробіть висновок про вміст білка в досліджуваних об'єктах. За результатами досліджень підготуйте презентацію.
Матеріали з хімії, планування з хімії, завдання та відповіді по класам, плани конспектів уроків з хімії для 9 класу
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: