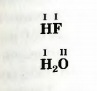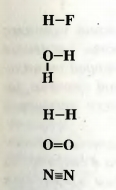|
Гипермаркет знаний>>Химия>>Химия 7 класс>> Валентность химических элементов. На досуге. «Конструируем» молекулы
> выяснить, что такое валентность элемента; Числовые индексы в химических формулах указывают на то, что атомы соединяются друг с другом не произвольно, а в определенных соотношениях. Способность атома соединяться с определенным количеством таких же или других атомов называют валентностью. Валентность является важным свойством атома. Ее определяют исходя из того, сколько атомов присоединяет данный атом и каким элементам они принадлежат. Значение валентности атома Гидрогена принято считать равным I. Этот атом всегда соединяется только с одним атомом. В результате образуются, например, молекулы водорода H2, фтороводорода HF, воды H2O:
В молекуле фтороводорода HF атом Флуора связан с атомом Гидрогена. Поэтому значение валентности Флуора, как и Гидрогена, равно I. Атом Оксигена удерживает в молекуле воды H2O два атома Гидрогена. Отсюда вывод: Оксиген двухвалентный элемент. 1 Термин происходит от латинского слова valentia — сила.
Значение валентности элемента при необходимости указывают в химической формуле римской цифрой над его символом: ► Определите валентность элементов в молекулах аммиака NH3 и метана CH4. Сведения о валентности элементов в веществе можно представить другим способом. Сначала записывают на определенном расстоянии друг от друга символы каждого атома, находящегося в молекуле. Затем одновалентный атом соединяют с другим одной черточкой, от двухвалентного атома проводят две черточки и т. д.: Молекула простого вещества водорода имеет графическую формулу H-H. Аналогичными являются графические формулы молекул фтора, хлора, брома, иода. Графическая формула молекулы кислорода 0=0, а молекулы азота Составляя такие формулы для молекул сложных веществ, следует иметь в виду, что атомы одного элемента, как правило, не соединены между собой. ► Изобразите графические формулы молекул аммиака и метана. Из графической формулы молекулы легко определить валентность каждого атома. Значение валентности равно количеству черточек, которые исходят от атома. Для соединений ионного и атомного строения графические формулы не используют.
Валентность элемента и его размещение в периодической системе. Некоторые элементы имеют постоянную валентность. В начале XIX в. во взглядах на состав химических соединений господствовал
Гидроген и Флуор всегда одновалентны, а Оксиген — двухвалентен. Другие элементы с постоянной валентностью находятся в I—III группах периодической системы, причем значение валентности каждого элемента совпадает с номером группы. Так, элемент I группы Литий одновалентен, элемент II группы Магний двухвалентен, а элемент III группы Бор трехвалентен. Исключениями являются элементы I группы Купрум (значения валентности — I и 2) и Аурум (I и 3). Большинство элементов имеют переменную валентность. Приводим ее значения для некоторых из них: Плюмбум (IV группа) — 2,4; Из этих сведений вытекает важное правило: максимальное значение валентности элемента совпадает с номером группы, в которой он находится1. Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от I до 8. Существует еще одно правило: значение валентности неметаллического элемента в соединении с Гидрогеном или с металлическим элементом равно 8 минус номер группы, в которой размещен элемент. Подтвердим его примерами соединений элементов с Гидрогеном. Элемент VII группы Иод в иодоводороде HI одновалентен (8-7=1), элемент VI группы Оксиген в воде H2O двухвалентен (8 - 6 = 2), элемент V группы Нитроген в аммиаке Бинарным2 называют соединение, образованное двумя элементами . Формулы соединений, образованных тремя и более элементами, составляют иначе. Выяснить значение валентности элемента в соединении нужно тогда, когда элемент имеет переменную валентность. Как выполняют такое задание, покажем на примере. Найдем значение валентности Иода в его соединении с Оксигеном, которое имеет формулу I2O5. Формула соединения с обозначением валентности элементов — ► Определите валентность элементов в соединениях с формулами CO2 и Cl2O7. Составление химических формул соединений по валентности элементов. Выполним задание, противоположное предыдущему, — составим химическую формулу соединения Сульфура с Оксигеном, в котором Сульфур шестивалентен. Сначала запишем символы элементов, образующих соединение, и укажем над ними значения валентности: Запомните, что в формулах соединений, в том числе бинарных, сначала записывают символы металлических элементов, а потом — неметаллических. Если соединение образовано только неметаллическими элементами и среди них есть Оксиген или Флуор, то эти элементы записывают последними. Порядок записи элементов в формуле соединения Оксигена с Флуором такой: OF2.
Причины соединения атомов друг с другом и объяснение значений валентности элементов связаны со строением атомов. Этот материал будет рассмотрен в 8 классе. Валентность — это способность атома соединяться с определенным количеством таких же или других атомов. Существуют элементы с постоянной и переменной валентностью. Гидроген и Флуор всегда одновалентны, Оксиген — двухвалентен. Значения валентности элементов отражают в графических формулах молекул соответствующим количеством черточек возле атомов. Произведения значений валентности каждого элемента на количество его атомов в формуле бинарного соединения одинаковы. 76. Укажите символы элементов, имеющих постоянную валентность: К, Ca, Cu, Cl, Zn, F, Н. 78. Определите валентность элементов в соединениях с такими формулами: 79. Составьте формулы соединений, образованных элементами с постоянной валентностью: Na...H..., Ba...F..., Al...О..., AI...F.... 80. Составьте формулы соединений, используя указанные валентности некоторых элементов: 82. Изобразите графические формулы молекул CI2O, PH3, SO3. 83. Определите валентность элементов по графическим формулам молекул:
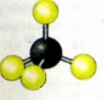
Изготовьте модели молекул H2, O2, H2O (имеет угловую форму), NH3 (имеет форму пирамиды), CO2 (имеет линейную форму).
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл. Содержание урока Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: