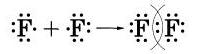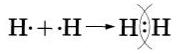|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Взаимодействие атомов элементов-неметаллов между собой
Мы уже рассмотрели, как взаимодействуют атомы элементов-металлов с атомами элементов-неметаллов: одни отдают свои внешние электроны и превращаются при этом в положительные ионы, другие принимают электроны и превращаются при этом в отрицательные ионы. Ионы притягиваются друг к другу, образуя ионные соединения.
А как осуществляется связь между атомами элементов-неметаллов, которые имеют сходную тенденцию к присоединению электронов? Рассмотрим вначале, как осуществляется связь между атомами одного и того же химического элемента, например в веществах, имеющих двухатомные молекулы: азота — N2, водорода — Н2, хлора — СL2.
Обратите внимание, что для отражения состава этих веществ с помощью химических знаков также пользуются индексами.
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом: обобществив свои внешние электроны, то есть сделав их общими для обоих атомов.
Рассмотрим, например, образование молекулы фтора F2.
Атомы фтора — элемента главной подгруппы VII группы — имеют на внешнем электронном уровне семь электронов, н каждому атому не хватает до его завершения лишь одного электрона. Внешние электроны атома фтора образуют три электронные пары и один непарный электрон:
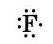
Бели сближаются два атома и у каждого из них есть но одному внешнему неспаренному электрону, то эти электроны «объединяются» и становятся общими для обоих атомов, у которых тем самым сформируется завершенный внешний восьмиэлектронный уровень.
Химическую связь, возникающую в результате образования общих электронных пар, называют атомной или ковалентной.
Образование молекулы фтора изображено на схеме:
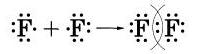
Если обозначить общую электронную пару черточкой, то запись называют структурной формулой, например структурная формула фтора F-F.
Аналогично молекуле фтора образуется и двухатомния молекула водорода Н2. следует учесть только, что завершенным для атома водорода будет двухэлектронный уровень, подобный завершенному уровню атома гелия.
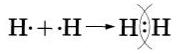
Структурная формула молекулы водорода Н—Н.
Попытаемся уточинть наши представления об образовании ковалентной связи на примере возникновения молекулы водорода, используя понятие электронного облака (см. §8). При сближении двух атомов водорода, имеющих по одному электронному облаку сферической формы, происходит перекрывание электронных облаков. При этом возникает область (место), где плотность отрицательного заряда наиболее высока и поэтому обладает повышенным отрицательным зарядом. Положительно заряженные ядра притягиваются к ней (это известно из курса физики), и образуется молекула. Таким образом, химическая связь- результат действия электрических сил.
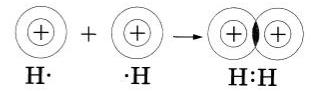
Нужно отметить, что в основе образования ковалентной связи так же. как и при возникновении ионной связи, лежит взаимодействие противоположных зарядов.
Следует подчеркнуть, что формальное понятие электронной пары при более точном рассмотрении природы ковалентной связи заменяется понятием — перекрывание электронных облаков, которое приобретает определенный физический смысл.
В заключение рассмотрим алгоритмы рассуждений, необходимых для того, чтобы записать схему образования ковалентной связи, например для молекулы азота N3.
1.Азот — это элемент главной подгруппы V группы. Его атомы имеют по пять электронов на внешнем уровне. Чтобы определить число неспяренных электронов, воспользуемся формулой:
8 — N = число неспарепных электронов.
где N — номер группы химического элемента.
Следовательно, атомы азота будут иметь (8-5 = 3) три неспаренныхэлектрона.
2. Запишем знаки химических элементов с обозначением внешних электронов так, чтобы неспаренные электроны были обращены к соседнему знаку:
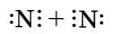
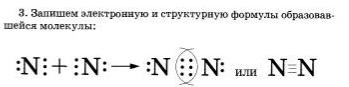
Если атомы связаны между собой одной общей электронной аарой. то такая коиялгнтная связь называется одинарной, если двумя - двойной, если тремя — тройной.
Чем больше общих электронных пар у атомоп а молекуле, тем прочнее, неразрывнее связаны они друг с другом и тем меньше расстояние между ядрами атомов, которое называется длиной сеяли. В молекулах фтора связь одинарная, и длина связи между ядрами атомов составляет 1,42 нанометра. В молекулах азота связь тройная, и длиннее составляет 0.11 нм.
Чтобы разделить молекулу азота на отдельные атомы, необходимо затратить примерно н семь раз больше энергии, чем для разрыва одинарных связей молекулы фтора.
1. Атомная, или ковалентная, химическая связь. 2. Одинарная, двойная н тройная ковалентвые химические сяязи. 3. Длина связи. 4. Электронные и структурные формулы.
Все элементы главной подгруппы VI! группы (подгруппы фтора) образуют простые вещества, состоящие из двухатомных молекул. Запишите электронную схему образования и структурную формулу таких молекул, пользуясь общим химическим законом для всей подгруппы Г (галоген).
Запишите схемы образования химических связей для веществ, состав которых отображается формулами KCl и Сl2.
Сколько неспаренных электронов имеют атомы серы? Какая связь будет в молекулах S2? Запишите схему образования связи для молекул S2 .
задания по химии для 8 класса, рефераты по химии, учебные пособия
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|