|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Дослідження властивостей основних класів неорганічних сполук. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
Хід урокуОсновні класи неорганічних сполук. УзагальненняВсі речовини поділяються на прості (елементарні) і складні. Прості речовини складаються з одного елемента, до складних входить два або більше елементів. Складні речовини, у свою чергу, поділяються на метали і неметали або металоїди. Складні речовини поділяються на органічні і неорганічні: органічними прийнято називати сполуки вуглецю; всі інші речовини називаються неорганічними. Неорганічні речовини поділяються на класи або за складом (двоелементні або бінарні сполуки і багатоелементні сполуки; кисневмісні, азотовмісні й т. п.), або за хімічними властивостями, тобто за функціями, які ці речовини здійснюють у хімічних реакціях - за їх функціональними ознаками. До вашої уваги наступне цікаве відео, з якого ви можете дізнатися які неорганічні речовини входять до складу клітини організму людини. Відео 1. Неорганічні речовини, що входять до складу клітин.
До найважливіших бінарних сполук відносяться сполуки елементів з киснем (оксиди), з галогенами (галогеніди або галіди), азотом (нітриди), вуглецем (карбіди), а також сполуки металевих елементів з воднем (гідриди). Щоб згадати основні властивості оксидів, пропонуємо до вашого перегляду наступне відео. Відео 2. Взаємодія основних оксидів металів з водою.
До найважливіших класів неорганічних сполук, які виділяються за функціональними ознаками, відносяться кислоти, основи і солі. Кислотами, з позиції теорії електролітичної дисоціації, називаються речовини, що дисоціюють в розчинах з утворенням іонів водню. Основами, з позиції електролітичної дисоціації, є речовини, що дисоціюють в розчинах з утворенням гідроксид-іонів, тобто основних гідроксидів. До солей відносяться речовини, що дисоціюють в розчинах з утворенням позитивно заряджених іонів, відмінних від іонів водню, і негативно заряджених іонів, відмінних від гідроксид-іонів. Контролюючий блок 1
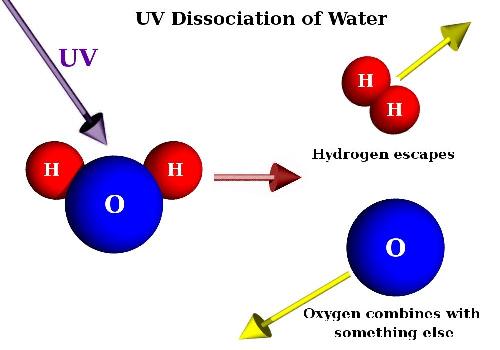
Дослідження властивостей основних класів неорганічних сполукВода є найпоширенішою сполукою водню; вона покриває дві третини поверхні земної кулі, заповнюючи океани, моря, озера, річки. Багато води знаходиться в земній корі, а у вигляді пари - в атмосфері. Вода може перебувати в твердому, рідкому і газоподібному стані. Перехід з одного стану в інший обумовлюється температурою і тиском. Дослід 1. Різниця між парою і туманом. У колбу ємністю 100 мл налити невелику кількість води; в шийку колби вставити скляну трубку завдовжки 5 см і діаметром 6 мм із злегка витягнутим зовнішнім кінцем. Встановивши колбу на триніжок, покритий азбестового сіткою, нагріти її до інтенсивного кипіння води. Утворюються пари води непомітні як в колбі, так і у отворі трубки, але над колбою утворюються клуби туману (крапельки конденсованої пари). Для рівномірного кипіння води всередину колби поміщають декілька шматочків пористого фарфора або скляних намистин. Мал.3 . Дисоціація води. Процес дисоціації води ви можете наглядно спостерігати на наступному відео. Відео 3. Дисоціація води.
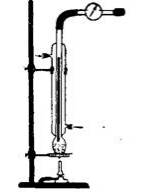
Чиста вода у всіх агрегатних станах безбарвна. Водяні пари невидимі. Дослід 2. Пари, видимі і невидимі. На столі встановлюють чотири великі склянки. У першу наливають трохи води, в другу - брому, в третю - спирту й до четвертої - бензину. Через деякий час повітря в кожній склянці насичується парами відповідної рідини. У склянці з бромом пари видимі, в склянках з водою, спиртом і бензином вони невидимі; в склянках зі спиртом і бензином їх можна виявити за запахом. Щільність чистої води при +4 ° С і тиску 760 мм рт. ст. приймають за одиницю. Дослід 3. Кипіння води при зниженому тиску. Прилад збирають відповідно до наступного малюнку. Мал. 4. Схема приладу. Він складається з холодильника Лібіха з внутрішньої трубкою з товстого і міцного скла, що закінчується внизу невеликий колбочки. У протилежному від колбочки кінці трубки повинен бути гачок для підвішування термометра. У колбу холодильника наливають трохи води, підвішують термометр таким чином, щоб його кулька з ртуттю знаходилася у воді колбочки, і зміцнюють холодильник у вертикальному положенні на штативі. Внутрішню трубку холодильника через запобіжну посудину і манометр з'єднують з водоструминним насосом. На початку досліду пропускають через холодильник воду і злегка нагрівають колбу, уважно спостерігаючи за температурою і тиском, при яких почне кипіти вода. Дуже сильного вакууму в цьому досліді допускати не слід, щоб уникнути розтріскування трубок. Мал. 5. Процес проведення досліду. Спрощений варіант досліду: нагріваємо воду в колбі до кипіння, знімаємо колбу з плитки і герметично закриваємо її пробкою - кипіння припиняється, поміщаємо колбу під струмінь холодної води - відновлюється бурхливе кипіння. Контролюючий блок 2
Домашнє завдання
Цікаво знати, що…Мабуть, немає такого учня, який би із захопленням не прочитав чудової казки І. Я. Франка «Фарбований лис». Та виявляється, рудого лиса можна «перефарбувати» і без фарби. На цупкому білому папері малюють лиса і вирізають малюнок ножицями. У хімічній склянці виготовляють насичений розчин K2Cr2O7 у розведеній H2SO4. Білого лиса повністю занурюють у цей розчин – вінс тає рудим. Мокрий малюнок вкидають у велику хімічну склянку, завчасно наповнену газоподібним SO2. Рудий лис від задушливого сірчастого газу сульфур (IV) оксид швидко стає блакитним або синім. Така метаморфоза відбувається завдяки окисно-відновному перетворенню. При цьому утворюється хромовий галун. Список використаних джерел1. Урок на тему «Оксиди та їх місце у нашому житті» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Князєва М.В. Сискова Р.Ф. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: