|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Кислородные соединения азота
Оксиды. Азот образует пять оксидов со степенями окисления +1, +2, +3, +4, +5.
Оксиды N20 и N0 несолеобразующие (что это означает?), а остальные оксиды — кислотные: N2O3 соответствует азотистая кислота НN02, а N205 — азотная кислота НNO3. Оксид азота(IV) N02, при растворении в воде образует одновременно две кислоты — HNO2 и НNO3.
Если же он растворяется в воде в присутствии избытка кислорода, получается только азотная кислота
4N02 + 02 + 2Н20 = 4НNO3
Оксид азота(IV) NO2 — бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота(П):
2NO + 02 = 2NO2
Азотная кислота НN03 — бесцветная жидкость, которая «дымится» на воздухе. При хранении на свету концентрированная азотная кислота желтеет, так как частично разлагается с образованием бурого газа N02.
Азотная кислота проявляет все типичные свойства сильных кислот: взаимодействует с оксидами и гидроксидами металлов, с солями. Но вот с металлами она ведет себя по-особому — ни один из металлов не вытесняет из азотной кислоты водород, независимо от ее концентрации (для серной кислоты такое поведение характерно только в ее концентрированном состоянии). Это объясняется тем, что НNO3 является сильным окислителем, в ней азот имеет максимальную степень окисления +5. Именно он и будет восстанавливаться при взаимодействии с металлами.
Продукт восстановления зависит от положения металла в ряду напряжений, от концентрации кислоты и условий проведения реакции. Например, при взаимодействии с медью концентрированная азотная кислота восстанавливается до оксида азота(IV):
Сu + 4НN03(конц) = Сu(NO3)2 + 2NO2 + 2Н20
а разбавленная — до оксида азота(ПII):
ЗСu + 8HN03(разб) = ЗСu(HNО3)2 + 2NO + 4Н20
Железо и алюминий при действии концентрированной HN03 покрывается прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т. е. кислота пассивирует их. Поэтому азотную кислоту, как и серную, можно перевозить в стальных и алюминиевых цистернах.
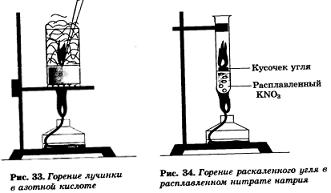
Азотная кислота окисляет многие органические вещества, обесцвечивает красители. При этом обычно выделяется много теплоты и вещество воспламеняется. Так, если к азотной кислоте прилить каплю скипидара, то происходит яркая вспышка, а тлеющая лучинка в ней загорается (рис. 33).
Азотная кислота широко применяется в химической промышленности для производства азотных удобрений, пластмасс, искусственных волокон, органических красителей и лаков, лекарств и взрывчатых веществ.
Соли азотной кислоты — нитраты получают при действии кислоты на металлы, их оксиды и гидроксиды. Нитраты натрия, калия, кальция и аммония называются селитрами: NaNO3 — натриевая селитра, КN03 — калийная селитра, Са(NO3)2 — кальциевая селитра, NН4О3 — аммиачная селитра. Все они применяются как азотные удобрения.
Калийная селитра используется также при изготовлении черного пороха, а из аммиачной селитры, как вы уже знаете, готовят взрывчатое вещество аммонал. Нитрат серебра, или ляпис, AgNOз применяется в медицине для прижигания ран, язв и др.
Почти все нитраты хорошо растворимы в воде. При нагревании они разлагаются с выделением кислорода.
Поэтому если в расплавленную в пробирке калийную селитру бросить кусочек раскаленного древесного угля, то он энергично сгорит, взаимодействуя с выделяющимся из селитры кислородом (рис. 34).
1. Несолеобразующие и кислотные оксиды азота.
2. Оксид азота(IV).
3. Свойства азотной кислоты как электролита и как окислителя.
4. Взаимодействие концентрированной и разбавленной азотной кислоты с медью.
5. Применение азотной кислоты.
6. Нитраты, селитры.
Почему азотная кислота не образует кислых солей?
Напишите молекулярные и ионные уравнения реакций азотной кислоты с гидроксидом меди(II), оксидом железа(III) и карбонатом натрия.
Большинство солей азотной кислоты растворимы в воде, тем не менее предложите уравнение реакции НNO3 с солью, в результате которой образуется осадок. Напишите ионное уравнение этой реакции.
Рассмотрите уравнения реакций разбавленной и концентрированной азотной кислоты с медью с точки зрения процессов окисления-восстановления.
Предложите две цепочки превращений, приводящих к получению азотной кислоты, исходя из азота и аммиака. Опишите окислительно-восстановительные реакции, используя метод электронного баланса.
Сколько килограммов 68%-ной азотной кислоты можно получить из 134,4 м3 оксида азота(IV)?
При прокаливании 340 г натриевой селитры получили 33,6 л кислорода. Какова массовая доля примесей в селитре?
схемы и таблицы к уроку химии, презентация урока 9 класса, интерактивные технологии
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











