|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Ковалентная полярная химическая связь'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Ковалентная полярная химическая связь, химическая связь</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Ковалентная полярная химическая связь'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Ковалентная полярная химическая связь, химическая связь</metakeywords> |
| | | | |
| - | При взаимодействии двух атомов одного и того же элемента-неметалла между ними образуется ковалентная химическая связь с помощью общих электронных пар. Эта конялеіпішн связь называется неполярной, так как общие электронные пары принадлежит обоим атомам а одинаковой степени и ни на одном из них не будет избытка или недостатка отрицательного заряда, который несут электроны. | + | При взаимодействии двух атомов одного и того же элемента-неметалла между ними образуется ковалентная химическая связь с помощью общих электронных пар. Эта ковалентная связь называется неполярной, так как общие электронные пары принадлежит обоим атомам а одинаковой степени и ни на одном из них не будет избытка или недостатка отрицательного заряда, который несут [[Состояние_электронов_в_атоме|электроны]]. |
| | | | |
| - | <br>Однако если ковалентная связь образуется между атомами разных элементов-неметаллов, то картина будет несколько иной. Рассмотрим, например, образование молекулы хлоро водорода НСl на атомов водородаи хлора. | + | <br>Однако если ковалентная связь образуется между атомами разных элементов-неметаллов, то картина будет несколько иной. Рассмотрим, например, образование молекулы хлоро водорода НСl на атомов водорода и хлора. |
| | | | |
| - | <br>1. Атом водорода имеет на единственноч уровне один электрон, и до его завершения ему не хватает еще одного электрона. Аналогично, у втома хлора иа внешнем уровне — семь электронов, и ему также недостает до завершения одного электрона. | + | <br>1. Атом водорода имеет на единственноч уровне один электрон, и до его завершения ему не хватает еще одного электрона. Аналогично, у втома хлора иа внешнем уровне — семь электронов, и ему также недостает до завершения одного электрона. |
| | | | |
| - | <br>2. Атомы нодороля и хлора объединяют свои непарные электроны и образуют одну общую электронную пару, то есть вступают и коналентиую связь, структурная формула H - СІ.<br><br>3. Так как ковалентная связь образуется между атомами различных элементов-неметаллов, то общая электронная пара будет принадлежать взаимодействующим атомам уже не в равной степени. Для того чтобы качественно определить, какому из этих атомов общая электронная пара будет принадлежать в большей мере, пользуются понятием электроотрицательности. | + | <br>2. Атомы нодороля и хлора объединяют свои непарные электроны и образуют одну общую электронную пару, то есть вступают и коналентиую связь, структурная формула H - СІ.<br><br>3. Так как ковалентная связь образуется между атомами различных элементов-[[Неметаллы:_атомы_и_простые_вещества._Кислород,_озон,_воздух|неметаллов]], то общая электронная пара будет принадлежать взаимодействующим атомам уже не в равной степени. Для того чтобы качественно определить, какому из этих атомов общая электронная пара будет принадлежать в большей мере, пользуются понятием электроотрицательности. |
| | | | |
| - | <u>''<br>Электроотрицательность (ЭО)''</u> — это способность атомов химическою мемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.<br><br>ЭО можно охарактеризовать как меру неметалличности химических элементов. В порядке уменьшения ЭО химические элементы располагаются в следующий ряд:<br> <br>[[Image:him8-38.jpg]]<br> | + | <u>''<br>Электроотрицательность (ЭО)''</u> — это способность атомов химическою мемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.<br><br>ЭО можно охарактеризовать как меру неметалличности химических элементов. В порядке уменьшения ЭО химические элементы располагаются в следующий ряд:<br> <br>[[Image:Him8-38.jpg|формула]]<br> |
| | | | |
| - | Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме? | + | [[Тонколистовой_металл_и_проволока|Металлы]] обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме? |
| | | | |
| - | <br>Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — 1, 2. 3. Эти электроны легко отрываютcя и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного нона к другому, связывая их в единое целое. | + | <br>Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — 1, 2. 3. Эти электроны легко отрываютcя и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного нона к другому, связывая их в единое целое. |
| | | | |
| - | <br>Разобраться, какой электрон принадлежал какому атому, прочти невозможно. Нес оторвавшиеся электроны стали общими. Соединяясь с ионвми. эти электроны образуют нременио атомы, потом снова отрываются и соединяются уже с другим ионом и т. д. Бесконечно происходит процесс: | + | <br>Разобраться, какой электрон принадлежал какому атому, прочти невозможно. Нес оторвавшиеся электроны стали общими. Соединяясь с ионвми. эти электроны образуют нременио атомы, потом снова отрываются и соединяются уже с другим ионом и т. д. Бесконечно происходит процесс: |
| | | | |
| - | [[Image:him8-39.jpg]]<br><br>Следовательно в объеме металла атомы непрерывно превращаются в ионы и наоборот. | + | [[Image:Him8-39.jpg|формула]]<br><br>Следовательно в объеме металла атомы непрерывно превращаются в ионы и наоборот. |
| | | | |
| - | <br>Связь в металлах между ионами посредством обобществленных электронов называется металлической.<br>[[Image:him8-40.jpg]] | + | <br>Связь в металлах между ионами посредством обобществленных электронов называется металлической.<br>[[Image:Him8-40.jpg|химия]] |
| | | | |
| - | <br>На рисунке 10 схематически изображено строение фрагмента металла натрия. Каждый атом натрия окружен восемью соседними атомами. Оторвавшиеся внешние электроны при сближении атомы свободно движутся от одного образовавшегося иона к другому, соединяя, будто склеивая, ионный остов натрия как бы в одну гигантскую молекулу. При этом небольшое число обобществленных электронов связывает большое число ионов и атомов. | + | <br>На рисунке 10 схематически изображено строение фрагмента металла натрия. Каждый атом натрия окружен восемью соседними атомами. Оторвавшиеся внешние электроны при сближении атомы свободно движутся от одного образовавшегося иона к другому, соединяя, будто склеивая, ионный остов натрия как бы в одну гигантскую молекулу. При этом небольшое число обобществленных электронов связывает большое число ионов и атомов. |
| | | | |
| - | [[Image:him8-41.jpg]] | + | [[Image:Him8-41.jpg|химия]] |
| | | | |
| - | <br>Металлическая связь имеет некоторое сходство с ковалентной. поскольку основана на обобществлении внешних электронов. Однако при к овале нт ной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск. | + | <br>Металлическая связь имеет некоторое сходство с ковалентной. поскольку основана на обобществлении внешних электронов. Однако при к овале нт ной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск. |
| | | | |
| - | <br>Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов-сплавов, находящихся и твердом и жидком состояниях. Однако в парообразном состоянии атомы металлов связаны между собой ковалентной связью (например, парами натрия заполняют лампы желтого света для освещения улиц больших городов). Пары металлов состоит из отдельных молекул (одноатомных и двухатомных). | + | <br>Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов-сплавов, находящихся и твердом и жидком состояниях. Однако в парообразном состоянии атомы металлов связаны между собой ковалентной связью (например, парами натрия заполняют лампы желтого света для освещения улиц больших городов). Пары металлов состоит из отдельных молекул (одноатомных и двухатомных). |
| | | | |
| - | <br>''Вопрос о связях в химических соединениях — центральный вопрос науки химии''. Вы познакомились с начальными представлениями о видах химической связи. В дальнейшем вы узнаете еще много интересного о природе химической связи. Например, что я большинстве металлов, кроме металлической связи, есть еще и ковалентная связь, что существуют и другие виды связей.<br> <br><br>1. Металлическая связь. 2. Обобществленные электроны.<br> <br>Металлическая связь имеет черты сходства с ковалентной связью. А что общего у нее с ионной связью? Что различного? | + | <br>''Вопрос о связях в химических соединениях — центральный вопрос науки [[Хімія_11_клас|химии]]''. Вы познакомились с начальными представлениями о видах химической связи. В дальнейшем вы узнаете еще много интересного о природе химической связи. Например, что я большинстве металлов, кроме металлической связи, есть еще и ковалентная связь, что существуют и другие виды связей.<br> <br><br>1. Металлическая связь. 2. Обобществленные электроны.<br> <br>Металлическая связь имеет черты сходства с ковалентной связью. А что общего у нее с ионной связью? Что различного? |
| | | | |
| - | <br>Как можно повысить твердость металлов и сплавов?<br><br>Запишите схему образования молекул Li2, для паров лития.<br> | + | <br>Как можно повысить твердость металлов и сплавов?<br><br>Запишите схему образования [[Маса_та_розміри_атомів_і_молекул._Презентація_уроку|молекул]] Li2, для паров лития.<br> |
| | | | |
| - | <br> <sub>таблицы к уроку [[Химия_8_класс|8 класса]], медиа [[Химия|для урока химии]], всё для учителей - [[Гипермаркет_знаний_-_первый_в_мире!|подготовка урока]]</sub> | + | <br> <sub>таблицы к уроку [[Химия 8 класс|8 класса]], медиа [[Химия|для урока химии]], всё для учителей - [[Гипермаркет знаний - первый в мире!|подготовка урока]]</sub> |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Текущая версия на 12:49, 27 июня 2012
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Ковалентная полярная химическая связь
При взаимодействии двух атомов одного и того же элемента-неметалла между ними образуется ковалентная химическая связь с помощью общих электронных пар. Эта ковалентная связь называется неполярной, так как общие электронные пары принадлежит обоим атомам а одинаковой степени и ни на одном из них не будет избытка или недостатка отрицательного заряда, который несут электроны.
Однако если ковалентная связь образуется между атомами разных элементов-неметаллов, то картина будет несколько иной. Рассмотрим, например, образование молекулы хлоро водорода НСl на атомов водорода и хлора.
1. Атом водорода имеет на единственноч уровне один электрон, и до его завершения ему не хватает еще одного электрона. Аналогично, у втома хлора иа внешнем уровне — семь электронов, и ему также недостает до завершения одного электрона.
2. Атомы нодороля и хлора объединяют свои непарные электроны и образуют одну общую электронную пару, то есть вступают и коналентиую связь, структурная формула H - СІ.
3. Так как ковалентная связь образуется между атомами различных элементов-неметаллов, то общая электронная пара будет принадлежать взаимодействующим атомам уже не в равной степени. Для того чтобы качественно определить, какому из этих атомов общая электронная пара будет принадлежать в большей мере, пользуются понятием электроотрицательности.
Электроотрицательность (ЭО) — это способность атомов химическою мемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
ЭО можно охарактеризовать как меру неметалличности химических элементов. В порядке уменьшения ЭО химические элементы располагаются в следующий ряд:

Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — 1, 2. 3. Эти электроны легко отрываютcя и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного нона к другому, связывая их в единое целое.
Разобраться, какой электрон принадлежал какому атому, прочти невозможно. Нес оторвавшиеся электроны стали общими. Соединяясь с ионвми. эти электроны образуют нременио атомы, потом снова отрываются и соединяются уже с другим ионом и т. д. Бесконечно происходит процесс:
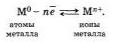
Следовательно в объеме металла атомы непрерывно превращаются в ионы и наоборот.
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
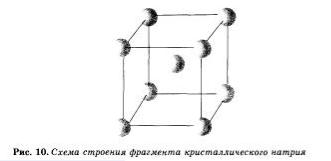
На рисунке 10 схематически изображено строение фрагмента металла натрия. Каждый атом натрия окружен восемью соседними атомами. Оторвавшиеся внешние электроны при сближении атомы свободно движутся от одного образовавшегося иона к другому, соединяя, будто склеивая, ионный остов натрия как бы в одну гигантскую молекулу. При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
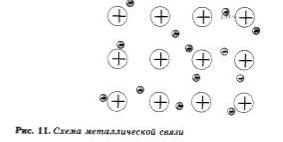
Металлическая связь имеет некоторое сходство с ковалентной. поскольку основана на обобществлении внешних электронов. Однако при к овале нт ной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов-сплавов, находящихся и твердом и жидком состояниях. Однако в парообразном состоянии атомы металлов связаны между собой ковалентной связью (например, парами натрия заполняют лампы желтого света для освещения улиц больших городов). Пары металлов состоит из отдельных молекул (одноатомных и двухатомных).
Вопрос о связях в химических соединениях — центральный вопрос науки химии. Вы познакомились с начальными представлениями о видах химической связи. В дальнейшем вы узнаете еще много интересного о природе химической связи. Например, что я большинстве металлов, кроме металлической связи, есть еще и ковалентная связь, что существуют и другие виды связей.
1. Металлическая связь. 2. Обобществленные электроны.
Металлическая связь имеет черты сходства с ковалентной связью. А что общего у нее с ионной связью? Что различного?
Как можно повысить твердость металлов и сплавов?
Запишите схему образования молекул Li2, для паров лития.
таблицы к уроку 8 класса, медиа для урока химии, всё для учителей - подготовка урока
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













