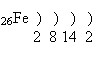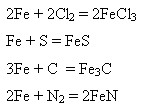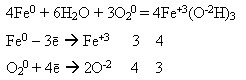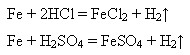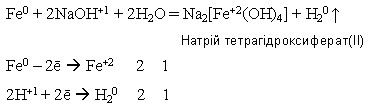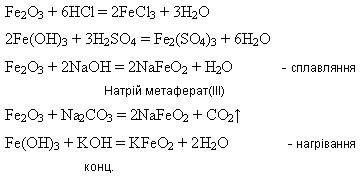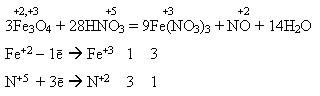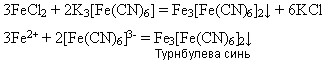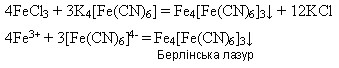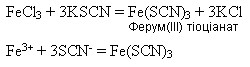|
Гіпермаркет Знань>>Хімія 10 клас>>Хімія>> Хімія: Ферум як представник металічних елементів побічних підгруп. Фізичні та хiмічні властивості заліза, сполуки Феруму(ІІ) і Феруму(ІІІ).
Тема: Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості Феруму (ІІ) і Феруму (ІІІ)
- освітня:розглянути фізичні й хімічні властивості заліза, сполук Феруму (ІІ) та Феруму (ІІІ), порівняти властивості сполук Феруму(ІІ) і Феруму (ІІІ), закріпити знання про залежність властивостей сполук Феруму від ступеня окиснення атомів, сформувати вміння учнів становити рівняння реакцій, які характеризують основні хімічні властивості заліза й сполук Феруму. - виховна: сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей заліза та його сполук, їх застосування; сприяти екологічному вихованню. - розвиваюча: 1) розвивати спостережливість учнів на уроці хімії; Тип уроку: Урок засвоєння нових знань та вмінь. Методи: загальні (ПІ), часткові (СНП), конкретні ( бесіда, розповідь). Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів.
1. Назвіть хімічні елементи головної підгрупи?
Ми вже з вами розглянули властивості Алюмінію та його сполук, а сьогодні розглянемо властивості заліза та його сполук.
- вміти: складати рівняння хімічних реакцій на прикладі хімічних властивостей Феруму та його сполук.
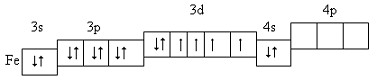
Положення в Періодичній системі.Учні характеризують положення Феруму у Періодичній системі хімічних елементів Д.І. Менделєєва. Будова атома Феруму. Учні обговорюють будову атома Феруму. Ферум – d-елемент VІІІБ групи (або побічної підгрупи VІІІ групи) періодичної системи.
Розміщення електронів зовнішнього і передостаннього енергетичних рівнів за енергетичними комірками:
Найхарактерніші ступені окиснення +2 і +3 Фізичні властивості заліза: Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см3 температура плавлення tпл=1535oС. Має здатність намагнічуватися.
Взаємодія з неметалами:
У розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
Залізо відновлює менш активні метали з розчинів їхніх солей:
Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу: Fe(OH)2 + 2NaOH = Na2[Fe(OH)4] //////////////////////////////////////////////////////// Натрій тетрагідроксиферат(ІІ) Ферум(ІІ) гідроксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІ):
Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
Ферум(ІІІ) оксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
2Fe(OH)3 = Fe2O3 + 3H2O Подвійний (змішаний) оксид. Під час взаємодії з кислотами утворює суміш двох солей – Феруму(ІІ) і Феруму(ІІІ): Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O Під час взаємодії з нітратною кислотою утворюється лише одна сіль – ферум(ІІІ) нітрат внаслідок окиснення сполук Феруму(ІІ) до сполук Феруму(ІІІ):
Реактивом на йони Феруму(ІІ) є червона кров’яна сіль K3[Fe(CN)6 ] - калій гексаціаноферат(ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:
Основні природні сполуки Феруму: Застосування: Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 • nH2O, сидерит FеСО3, пірит FеS2. Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень:
Чит. §31-32 . Надіслано Шевченко В.В, вчителем хімії та біології
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: