|
Гіпермаркет Знань>>Фізика і астрономія>>Фізика 9 клас>> Фізика і астрономія: Будова атома. Електрон. Йон
§3. Будова атома. Електрон. Йон. Пояснення електризації. Рис. 14 Модель атома за Томсоном
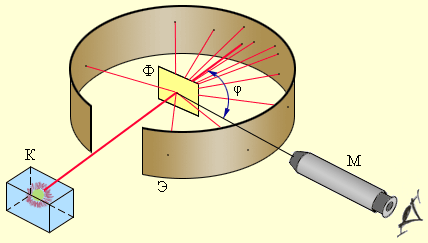
Рис.15 Схема досліду Резерфорда
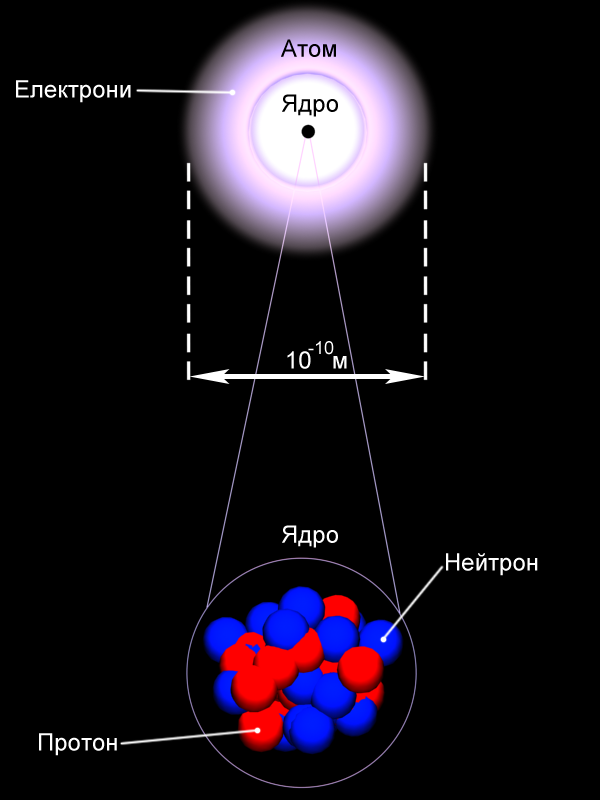
Згодом Резерфорд встановлює існування частки з найменшим позитивним зарядом – протона. Ця частка виявилася ядром атома найлегшої речовини – гідрогену. 1932 року, британський фізик Джеймс Чедвік відкриває існування в ядрах атомів часток без електричного заряду, маса яких складала 1,67×10-27 кг, на долі відсотка перевищуючи масу протона. Ії назвали нейтроном. З відкриттям нейтрона склад атомів було повністю пояснено, хоча внутрішня будова ще тривалий час з’ясовувалася. Рис.16 Будова атома
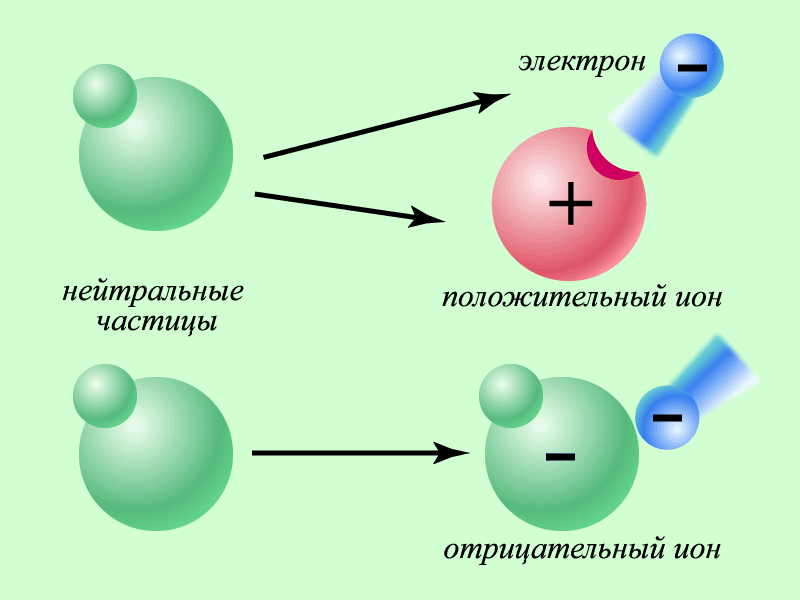
Склад атома речовини визначається за її розміщенням у періодичній системі Менделєєва. Кожний елемент у системі має порядковий номер Z та масове число A. Порядковий номер Z відповідає кількості протонів у атомному ядрі. Кількість електронів буде такою ж, якщо атом у цілому нейтральний. Масове число А вказує загальну кількість протонів та нейтронів. Для прикладу склад атому урану23892U : кількість протонів Z=92, кількість електронів в нейтральному атомі – 92, кількість нейтронів N = 238 – 92 = 146. Питання про розміщення електронів у атомах виявилося набагато складнішим, оскільки на рівні мікросвіту працюють закони квантової фізики, що відрізняються від звичайних уявлень про простір та час. Ділянки в яких можуть перебувати електрони в атомах називають електронними орбіталями. Взаємодія електронів з атомними ядрами залежить від їхньої орбіталі, що також визначається позицією елемента в періодичній системі Менделєєва. Наслідком цього є те, що в різних атомів взаємодія електронів з ядрами різна! Рис. 17 Утворення йонів
У разі втрачання або приєднання нейтральним атомом одного, або кількох електронів він перетворюється на заряджену частку з позитивним або негативним зарядом відповідно. Такі атоми називають – позитивні або негативні йони. На основі цих фактів знаходить пояснення явище електризації тіл та поділ речовин на ровідники та ізолятори. При трибоелектризації ми приводимо у контакт речовини, в атомах яких електрони по різному взаємодіють з ядрами. Існує велика ймовірність захоплення електронів одними атомами у інших (відео 2). Чим більша площа контакту тим більше атомів приймають участь у цьому процесі. Провідниками виступають речовини, ядра атомів яких, слабко утримують зовнішні електрони. За рахунок їх звільнення всередині тіла вони можуть рухатися вільно. В ізоляторах спостерігається сильний зв’язок електронів з ядрами. Проте при створенні додаткових умов, які сприяють відокремленню електронів (наприклад, сильному нагріванні) ізолятори перетворюються на провідники. Варто уваги пояснення явища електризації наведенням. Це явище спостерігається в провідних середовищах (відео 3) і може легко відтворитися на вашому саморобному електроскопі. При піднесенні зарядженого тіла до петлі електроскопа, за рахунок рухомих електронів, у провіднику відбувається перерозподіл зарядів, внаслідок якого петля отримує заряд, протилежний за знаком тілу, що підносять. При доторку до петлі пальцем, за рахунок того, що наше тіло провідник, цей заряд перерозподіляється на все тіло. При відриві пальця і усуненні зарядженого тіла на електроскопі залишається заряд, що за знаком співпадає з тілом яке підносилось до електроскопа. Подібну картину спостерігаємо, коли на петлі електроскопа встановлено вістря, що сприяє розсіюванню електронів або їх нагромадженню з повітря (відео 4).
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: