|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 7 клас|Хімія 7 клас]]>> Хімія: Масова частка елемента в речовині''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 7 клас|Хімія 7 клас]]>> Масова частка елемента в речовині''' |
| | | | |
| | <metakeywords>Хімія, Хімія клас 7, тема уроку, Масова частка елемента в речовині</metakeywords> | | <metakeywords>Хімія, Хімія клас 7, тема уроку, Масова частка елемента в речовині</metakeywords> |
| | | | |
| - | '''Масова частка елемента в речовині '''— це фізична величина, що визначається відношенням маси, яка припадає на елемент, до маси всієї речовини.<br>Масова частка позначається W (читається дубль-ве) і виражається у частках одиниці або у відсотках. Спосіб обчислення полягає у знаходженні частини від цілого за формулою:<br>W = nA<sub>r</sub> / M<sub>r</sub><br>де W — масова частка елемента; А<sub>r</sub> — відносна атомна маса елемента; n — кількість атомів елемента у формулі; М<sub>r</sub> — відносна молекулярна або формульна маса речовини.<br>Приклад. Обчисли масову частку Алюмінію у глиноземі Аl<sub>2</sub>О<sub>3</sub>.<br><br>Розв' язання.<br>Дано: <br>Аl<sub>2</sub>O<sub>3</sub> <br>W(Al) = ? <br><br>М<sub>r</sub>(Аl<sub>2</sub>О<sub>3</sub>) = 2А<sub>r</sub>(Аl) + ЗА<sub>r</sub>(O);<br>М<sub>r</sub>(Аl<sub>2</sub>О<sub>3</sub>) = 2 • 27 + 3 • 16 = 102;<br>W(Al) = 54/102 = 0,53, або 53 %<br>Відповідь. Масова частка Алюмінію в глиноземі становить 53 %.<br><br>Знаючи масову частку елемента в речовині, можна знайти і масу елемента, який у вигляді простої речовини можна добути з будь-якої маси речовини.<br>Приклад. Визнач, яку масу алюмінію можна дістати з глинозему масою 200 тис. т, якщо відомо, що масова частка Алюмінію в глиноземі становить 53 %.<br><br>Розв' язання.<br>Дано:<br>m(Аl<sub>2</sub>O<sub>3</sub>) = 200 тис. т <br>W(Аl) = 53 % = 0,53 <br>m(Аl) — ?<br><br>З умови задачі відомо, що глинозем масою 1 т містить 1 т • 0,53 = 0,53 т Аl, а 200 тис. т — 200 тис. т • 0,53 = 106 тис. т Аl.<br>Відповідь. З глинозему Аl<sub>2</sub>О<sub>3</sub> масою 200 тис. т можна дістати алюміній масою 106 тис. т.<br><br>Якщо треба обчислити ще й масову частку Оксигену в глиноземі, то:<br>W(O) = 100 % - 53 % = 47 %, або<br>W(О) = 48/102 = 0,47 = 47 %.<br>Зрозуміло, що сума масових часток усіх елементів у сполуці дорівнює 1, або 100 %. Це потрібно брати до уваги під час перевірки правильності обчислень.<br>Варто звернути увагу на обернену задачу. Адже, знаючи масові частки елементів, можна знайти хімічну формулу речовини.<br>Приклад. Виведи формулу речовини, якщо відомо, що до її складу входить Сульфур (масова частка становить 40 %) і Оксиген.<br>Розв'язання.<br>Дано: <br>W(S) = 40 %<br>W(О) = 60 %<br>S<sub>x</sub>O<sub>y</sub> - ? <br>Позначимо число атомів Сульфуру через х, атомів Оксигену — через у. Число атомів у речовині прямо пропорційне масовій частці елемента й обернено пропорційне його відносній атомній масі, тобто | + | '''[[Кількісний_склад_розчину._Масова_частка_розчиненої_речовини._Виготовлення_розчину|Масова частка елемента в речовині]] '''— це [[Презентація_на_тему_«Фізичні_величини.Вимірювання_фізичних_величин»|фізична величина]], що визначається відношенням [[Атомна_одиниця_маси._Відносна_атомна_маса_хімічних_елементів|маси]], яка припадає на елемент, до маси всієї [[Ілюстрації_до_уроку_«Прості_і_складні_речовини._Поняття_про_неорганічні_та_органічні_речовини.»|речовини]].<br>Масова частка позначається W (читається дубль-ве) і виражається у частках одиниці або у відсотках. Спосіб обчислення полягає у знаходженні частини від цілого за формулою:<br>W = nA<sub>r</sub> / M<sub>r</sub><br>де W — масова частка елемента; А<sub>r</sub> — відносна атомна маса елемента; n — кількість атомів елемента у формулі; М<sub>r</sub> — відносна молекулярна або формульна маса речовини.<br>Приклад. Обчисли масову частку Алюмінію у глиноземі Аl<sub>2</sub>О<sub>3</sub>.<br><br>Розв' язання.<br>Дано: <br>Аl<sub>2</sub>O<sub>3</sub> <br>W(Al) = ? <br><br>М<sub>r</sub>(Аl<sub>2</sub>О<sub>3</sub>) = 2А<sub>r</sub>(Аl) + ЗА<sub>r</sub>(O);<br>М<sub>r</sub>(Аl<sub>2</sub>О<sub>3</sub>) = 2 • 27 + 3 • 16 = 102;<br>W(Al) = 54/102 = 0,53, або 53 %<br>Відповідь. Масова частка Алюмінію в глиноземі становить 53 %.<br><br>Знаючи масову частку елемента в речовині, можна знайти і масу елемента, який у вигляді простої речовини можна добути з будь-якої маси речовини.<br>Приклад. Визнач, яку масу алюмінію можна дістати з глинозему масою 200 тис. т, якщо відомо, що масова частка Алюмінію в глиноземі становить 53 %.<br><br>Розв' язання.<br>Дано:<br>m(Аl<sub>2</sub>O<sub>3</sub>) = 200 тис. т <br>W(Аl) = 53 % = 0,53 <br>m(Аl) — ?<br><br>З умови задачі відомо, що глинозем масою 1 т містить 1 т • 0,53 = 0,53 т Аl, а 200 тис. т — 200 тис. т • 0,53 = 106 тис. т Аl.<br>Відповідь. З глинозему Аl<sub>2</sub>О<sub>3</sub> масою 200 тис. т можна дістати алюміній масою 106 тис. т.<br><br>Якщо треба обчислити ще й масову частку Оксигену в глиноземі, то:<br>W(O) = 100 % - 53 % = 47 %, або<br>W(О) = 48/102 = 0,47 = 47 %.<br>Зрозуміло, що сума масових часток усіх елементів у сполуці дорівнює 1, або 100 %. Це потрібно брати до уваги під час перевірки правильності обчислень.<br>Варто звернути увагу на обернену задачу. Адже, знаючи масові частки елементів, можна знайти [[Хімічні_формули_речовин|хімічну формулу]] речовини.<br>Приклад. Виведи формулу речовини, якщо відомо, що до її складу входить Сульфур (масова частка становить 40 %) і Оксиген.<br>Розв'язання.<br>Дано: <br>W(S) = 40 %<br>W(О) = 60 %<br>S<sub>x</sub>O<sub>y</sub> - ? <br>Позначимо число атомів Сульфуру через х, атомів Оксигену — через у. Число атомів у речовині прямо пропорційне масовій частці елемента й обернено пропорційне його відносній атомній масі, тобто |
| | | | |
| - | [[Image:розвяз.jpg]]<br>Знайдені числа виражають кількісне відношення між атомами елементів. Але відношення між атомами може бути виражене тільки цілими числами. Тому обираємо найменше із знайдених чисел, приймаємо його за одиницю і ділимо на нього решту чисел: | + | [[Image:Розвяз.jpg|формула. фото]]<br>Знайдені числа виражають кількісне відношення між атомами елементів. Але відношення між атомами може бути виражене тільки цілими числами. Тому обираємо найменше із знайдених чисел, приймаємо його за одиницю і ділимо на нього решту чисел: |
| | | | |
| - | [[Image:розвязан.jpg]]<br>Відповідь. Формула речовини SO<sub>3</sub>.<br><br>КОРОТКІ ВИСНОВКИ<br>Молекули, атоми, йони, будь-які інші структурні частинки речовини розрізняються між собою масою, оскільки вони утворені атомами різних елементів, які теж відмінні за масою.<br>Відносна молекулярна (або формульна) маса речовини позначається Мr. Це безрозмірна величина, яка дорівнює сумі відносних атомних мас хімічних елементів, що входять до складу цієї речовини з урахуванням її формули. Масова частка елемента в речовині — це також безрозмірна фізична величина, що дорівнює відношенню маси елемента до загальної маси речовини.<br>Знаючи масову частку елемента, можна визначити його масу в будь-якій масі речовини і за масовими частками елементів визначити формулу речовини.<br><br>Завдання для самоконтролю<br>1. Обчисли відносну молекулярну (формульну) масу таких речовин: озону O<sub>3</sub>, магній оксиду MgO, соди Ма<sub>2</sub>СO<sub>3</sub>.<br>2. Молекула сахарози складається з 12 атомів Карбону, 22 атомів Гідрогену й 11 атомів Оксигену. Напиши формулу сахарози й обчисли її відносну молекулярну масу. <br>3. Формульна маса гашеного вапна Са(OН)<sub>2</sub> становить<br>(а) 3,7; (б) 37; (в) 7,4; (г) 74.<br>4. Обчисли масові частки елементів у мінералі піриті FеS2 (вважати, що домішки відсутні).<br>5. В якому оксиді — SO<sub>2</sub> чи SO<sub>3</sub> — масова частка Оксигену більша? Розв'яжи усно, а відповідь підтвердь розрахунком.<br>6. Яку масу заліза можна добути з червоного залізняку масою 2 т, якщо масова частка Fе<sub>2</sub>O<sub>3</sub> становить 70 % (можливими втратами знехтувати)?<br><br>Додаткові завдання<br>7. Відносна молекулярна маса ортофосфатної кислоти Н<sub>3</sub>РO<sub>4</sub> дорівнює<br>(а) 98 а.о.м.; (б) 98 г; (в) 98; (г)98кг.<br>8. Абсолютна молекулярна маса карбон(ІV) оксиду дорівнює<br>(а) 44 а.о.м.; (б) 44 г; (в) 44; (г)44кг.<br>9. У сульфатній кислоті Н2SO4 масові частки елементів становлять<br>(а) Н — 2,0 %; S — 32,7 %; O — 65,3 %;<br>(б) Н — 10 %; S — 17 %; O — 73 %;<br>(в) Н — 65,3%; S — 32,7%; О — 2,0%;<br>(г) Н — 2; S —1; O — 4.<br>10*. Відносна молекулярна маса оксиду елемента першої групи періодичної системи дорівнює 94. Визнач елемент, запиши його символ і назву.<br>11*. Виведи формулу речовини, якщо відомо, що масова частка Карбону в ній становить 75 %, а Гідрогену — 25 %.<br>12*. Виведи формулу речовини, у складі якої масова частка Кальцію дорівнює 0,4, Карбону — 0,12, Оксигену — 0,48.<br>13*. Склади на свій розсуд пряму й обернену задачі для розрахунків за формулою Сr<sub>2</sub>O<sub>3</sub> та розв'яжи їх.<br> | + | [[Image:Розвязан.jpg|Формула . фото]]<br>Відповідь. Формула речовини SO<sub>3</sub>.<br><br>'''КОРОТКІ ВИСНОВКИ'''<br>[[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи|Молекули]], [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|атоми]], [[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_симовли._Повні_уроки|йони]], будь-які інші структурні частинки речовини розрізняються між собою масою, оскільки вони утворені атомами різних елементів, які теж відмінні за масою.<br>Відносна молекулярна (або формульна) маса речовини позначається Мr. Це безрозмірна величина, яка дорівнює сумі відносних атомних мас хімічних елементів, що входять до складу цієї речовини з урахуванням її формули. Масова частка елемента в речовині — це також безрозмірна фізична величина, що дорівнює відношенню маси елемента до загальної маси речовини.<br>Знаючи масову частку елемента, можна визначити його масу в будь-якій масі речовини і за масовими частками елементів визначити формулу речовини.<br><br>'''Завдання для самоконтролю'''<br>''1. Обчисли відносну молекулярну (формульну) масу таких речовин: озону O<sub>3</sub>, магній оксиду MgO, соди Ма<sub>2</sub>СO<sub>3</sub>.<br>2. Молекула сахарози складається з 12 атомів Карбону, 22 атомів Гідрогену й 11 атомів Оксигену. Напиши формулу сахарози й обчисли її відносну молекулярну масу. <br>3. Формульна маса гашеного вапна Са(OН)<sub>2</sub> становить<br>(а) 3,7; (б) 37; (в) 7,4; (г) 74.<br>4. Обчисли масові частки елементів у мінералі піриті FеS2 (вважати, що домішки відсутні).<br>5. В якому оксиді — SO<sub>2</sub> чи SO<sub>3</sub> — масова частка Оксигену більша? Розв'яжи усно, а відповідь підтвердь розрахунком.<br>6. Яку масу заліза можна добути з червоного залізняку масою 2 т, якщо масова частка Fе<sub>2</sub>O<sub>3</sub> становить 70 % (можливими втратами знехтувати)?<br>''<br>'''Додаткові завдання'''<br>''7. Відносна молекулярна маса ортофосфатної кислоти Н<sub>3</sub>РO<sub>4</sub> дорівнює<br>(а) 98 а.о.м.; (б) 98 г; (в) 98; (г)98кг.<br>8. Абсолютна молекулярна маса карбон(ІV) оксиду дорівнює<br>(а) 44 а.о.м.; (б) 44 г; (в) 44; (г)44кг.<br>9. У сульфатній кислоті Н2SO4 масові частки елементів становлять<br>(а) Н — 2,0 %; S — 32,7 %; O — 65,3 %;<br>(б) Н — 10 %; S — 17 %; O — 73 %;<br>(в) Н — 65,3%; S — 32,7%; О — 2,0%;<br>(г) Н — 2; S —1; O — 4.<br>10*. Відносна молекулярна маса оксиду елемента першої групи періодичної системи дорівнює 94. Визнач елемент, запиши його символ і назву.<br>11*. Виведи формулу речовини, якщо відомо, що масова частка Карбону в ній становить 75 %, а Гідрогену — 25 %.<br>12*. Виведи формулу речовини, у складі якої масова частка Кальцію дорівнює 0,4, Карбону — 0,12, Оксигену — 0,48.<br>13*. Склади на свій розсуд пряму й обернену задачі для розрахунків за формулою Сr<sub>2</sub>O<sub>3</sub> та розв'яжи їх.''<br> |
| | + | |
| | + | |
| | + | ''[[Хімія_7_клас|Хімія 7.]] Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська'' |
| | | | |
| - | Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
| |
| | | | |
| | Планування уроків з [[Хімія|хімії]] , відповіді на тести, [[Гіпермаркет Знань - перший в світі!|завдання та відповіді по класам]] , домашнє завадання та робота з [[Хімія 7 клас|хімії 7 класу]]<br> | | Планування уроків з [[Хімія|хімії]] , відповіді на тести, [[Гіпермаркет Знань - перший в світі!|завдання та відповіді по класам]] , домашнє завадання та робота з [[Хімія 7 клас|хімії 7 класу]]<br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%9A%D0%BE%D0%BD%D1%81%D0%BF%D0%B5%D0%BA%D1%82_%D1%83%D1%80%D0%BE%D0%BA%D1%83_%D1%96_%D0%BE%D0%BF%D0%BE%D1%80%D0%BD%D0%B8%D0%B9_%D0%BA%D0%B0%D1%80%D0%BA%D0%B0%D1%81 конспект уроку і опорний каркас] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%9A%D0%BE%D0%BD%D1%81%D0%BF%D0%B5%D0%BA%D1%82_%D1%83%D1%80%D0%BE%D0%BA%D1%83_%D1%96_%D0%BE%D0%BF%D0%BE%D1%80%D0%BD%D0%B8%D0%B9_%D0%BA%D0%B0%D1%80%D0%BA%D0%B0%D1%81 конспект уроку і опорний каркас] |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%97%D0%B0%D0%B4%D0%B0%D1%87%D1%96_%D1%82%D0%B0_%D0%B2%D0%BF%D1%80%D0%B0%D0%B2%D0%B8,%D1%81%D0%B0%D0%BC%D0%BE%D0%BF%D0%B5%D1%80%D0%B5%D0%B2%D1%96%D1%80%D0%BA%D0%B0 задачі та вправи,самоперевірка] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%97%D0%B0%D0%BF%D0%B8%D1%81_%D1%96_%D1%87%D0%B8%D1%82%D0%B0%D0%BD%D0%BD%D1%8F_%D1%82%D1%80%D0%B8%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%B8%D1%85_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%92%D0%B8%D0%BF%D0%B0%D0%B4%D0%BA%D0%B8_%D0%B4%D0%BE%D0%B4%D0%B0%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%96_%D0%B2%D1%96%D0%B4%D0%BD%D1%96%D0%BC%D0%B0%D0%BD%D0%BD%D1%8F,_%D0%BF%D0%BE%D0%B2%27%D1%8F%D0%B7%D0%B0%D0%BD%D1%96_%D0%B7_%D0%BD%D1%83%D0%BC%D0%B5%D1%80%D0%B0%D1%86%D1%96%D1%94%D1%8E_%D1%87%D0%B8%D1%81%D0%B5%D0%BB._%D0%97%D0%B0%D0%B4%D0%B0%D1%87%D1%96_%D1%82%D0%B0_%D0%B2%D0%BF%D1%80%D0%B0%D0%B2%D0%B8,%D1%81%D0%B0%D0%BC%D0%BE%D0%BF%D0%B5%D1%80%D0%B5%D0%B2%D1%96%D1%80%D0%BA%D0%B0 задачі та вправи,самоперевірка] |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | | | |
Текущая версия на 08:24, 9 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 7 клас>> Масова частка елемента в речовині
Масова частка елемента в речовині — це фізична величина, що визначається відношенням маси, яка припадає на елемент, до маси всієї речовини.
Масова частка позначається W (читається дубль-ве) і виражається у частках одиниці або у відсотках. Спосіб обчислення полягає у знаходженні частини від цілого за формулою:
W = nAr / Mr
де W — масова частка елемента; Аr — відносна атомна маса елемента; n — кількість атомів елемента у формулі; Мr — відносна молекулярна або формульна маса речовини.
Приклад. Обчисли масову частку Алюмінію у глиноземі Аl2О3.
Розв' язання.
Дано:
Аl2O3
W(Al) = ?
Мr(Аl2О3) = 2Аr(Аl) + ЗАr(O);
Мr(Аl2О3) = 2 • 27 + 3 • 16 = 102;
W(Al) = 54/102 = 0,53, або 53 %
Відповідь. Масова частка Алюмінію в глиноземі становить 53 %.
Знаючи масову частку елемента в речовині, можна знайти і масу елемента, який у вигляді простої речовини можна добути з будь-якої маси речовини.
Приклад. Визнач, яку масу алюмінію можна дістати з глинозему масою 200 тис. т, якщо відомо, що масова частка Алюмінію в глиноземі становить 53 %.
Розв' язання.
Дано:
m(Аl2O3) = 200 тис. т
W(Аl) = 53 % = 0,53
m(Аl) — ?
З умови задачі відомо, що глинозем масою 1 т містить 1 т • 0,53 = 0,53 т Аl, а 200 тис. т — 200 тис. т • 0,53 = 106 тис. т Аl.
Відповідь. З глинозему Аl2О3 масою 200 тис. т можна дістати алюміній масою 106 тис. т.
Якщо треба обчислити ще й масову частку Оксигену в глиноземі, то:
W(O) = 100 % - 53 % = 47 %, або
W(О) = 48/102 = 0,47 = 47 %.
Зрозуміло, що сума масових часток усіх елементів у сполуці дорівнює 1, або 100 %. Це потрібно брати до уваги під час перевірки правильності обчислень.
Варто звернути увагу на обернену задачу. Адже, знаючи масові частки елементів, можна знайти хімічну формулу речовини.
Приклад. Виведи формулу речовини, якщо відомо, що до її складу входить Сульфур (масова частка становить 40 %) і Оксиген.
Розв'язання.
Дано:
W(S) = 40 %
W(О) = 60 %
SxOy - ?
Позначимо число атомів Сульфуру через х, атомів Оксигену — через у. Число атомів у речовині прямо пропорційне масовій частці елемента й обернено пропорційне його відносній атомній масі, тобто

Знайдені числа виражають кількісне відношення між атомами елементів. Але відношення між атомами може бути виражене тільки цілими числами. Тому обираємо найменше із знайдених чисел, приймаємо його за одиницю і ділимо на нього решту чисел:
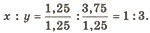
Відповідь. Формула речовини SO3.
КОРОТКІ ВИСНОВКИ
Молекули, атоми, йони, будь-які інші структурні частинки речовини розрізняються між собою масою, оскільки вони утворені атомами різних елементів, які теж відмінні за масою.
Відносна молекулярна (або формульна) маса речовини позначається Мr. Це безрозмірна величина, яка дорівнює сумі відносних атомних мас хімічних елементів, що входять до складу цієї речовини з урахуванням її формули. Масова частка елемента в речовині — це також безрозмірна фізична величина, що дорівнює відношенню маси елемента до загальної маси речовини.
Знаючи масову частку елемента, можна визначити його масу в будь-якій масі речовини і за масовими частками елементів визначити формулу речовини.
Завдання для самоконтролю
1. Обчисли відносну молекулярну (формульну) масу таких речовин: озону O3, магній оксиду MgO, соди Ма2СO3.
2. Молекула сахарози складається з 12 атомів Карбону, 22 атомів Гідрогену й 11 атомів Оксигену. Напиши формулу сахарози й обчисли її відносну молекулярну масу.
3. Формульна маса гашеного вапна Са(OН)2 становить
(а) 3,7; (б) 37; (в) 7,4; (г) 74.
4. Обчисли масові частки елементів у мінералі піриті FеS2 (вважати, що домішки відсутні).
5. В якому оксиді — SO2 чи SO3 — масова частка Оксигену більша? Розв'яжи усно, а відповідь підтвердь розрахунком.
6. Яку масу заліза можна добути з червоного залізняку масою 2 т, якщо масова частка Fе2O3 становить 70 % (можливими втратами знехтувати)?
Додаткові завдання
7. Відносна молекулярна маса ортофосфатної кислоти Н3РO4 дорівнює
(а) 98 а.о.м.; (б) 98 г; (в) 98; (г)98кг.
8. Абсолютна молекулярна маса карбон(ІV) оксиду дорівнює
(а) 44 а.о.м.; (б) 44 г; (в) 44; (г)44кг.
9. У сульфатній кислоті Н2SO4 масові частки елементів становлять
(а) Н — 2,0 %; S — 32,7 %; O — 65,3 %;
(б) Н — 10 %; S — 17 %; O — 73 %;
(в) Н — 65,3%; S — 32,7%; О — 2,0%;
(г) Н — 2; S —1; O — 4.
10*. Відносна молекулярна маса оксиду елемента першої групи періодичної системи дорівнює 94. Визнач елемент, запиши його символ і назву.
11*. Виведи формулу речовини, якщо відомо, що масова частка Карбону в ній становить 75 %, а Гідрогену — 25 %.
12*. Виведи формулу речовини, у складі якої масова частка Кальцію дорівнює 0,4, Карбону — 0,12, Оксигену — 0,48.
13*. Склади на свій розсуд пряму й обернену задачі для розрахунків за формулою Сr2O3 та розв'яжи їх.
Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
Планування уроків з хімії , відповіді на тести, завдання та відповіді по класам , домашнє завадання та робота з хімії 7 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











