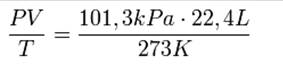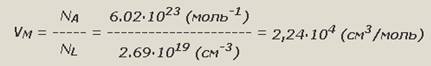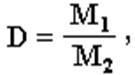|
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Молярный объем газов. Полные уроки Тема: Молярный объем газов.
Цели урока:
Задачи урока:• обучающие: изучит закон объемных отношений, закон Авогадро, научиться решать задачи; • развивающие: сформировать познавательный интерес к химии, умение выделять признаки и свойства объектов, делать выводы и устанавливать причинно-следственные связи; • воспитательные: развить коммуникативные навыки учащихся.
Основные термины:Закон Авогадро – это один из самых важных законов химии (сформулирован Амадео Авогадро в 1811г), гласящий, что «в равных объемах разных газов, которые взяты при одинаковом давлении и температуре, содержится одинаковое число молекул». Молярный объем газов – объем газа, содержащий 1 моль частиц этого газа. Нормальные условия – температура 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
Ход урока:Проверка домашнего задания.Ответьте на вопросы: 1. Что называется атомом? (Атом – самая мелкая химически неделимая часть химического элемента, которая является носителем его свойств). 2. Что такое моль? (Моль - это количества вещества, которое равно 6,02.1023 структурных единиц этого вещества – молекул, атомов, ионов. Это количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода). 3. В чем измеряется количество вещества? (В моль). 4. В чем измеряется масса вещества? (Масса вещества измеряется в граммах). 5. Что такое молярная масса и в чем она измеряется? (Молярная масса – это масса 1 моль вещества. Она измеряется в г/моль).
Закон Авогадро. Постоянная Авогадро.Перед тем, как начать изучать новую тему, давайте освежим в памяти, что такое атом:
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку, который является автором закона объемных отношений и законов о тепловом расширении газов. Закон объемных отношений гласит, что при постоянных давлении и температуре объемы вступающих в реакцию газов относятся друг к другу как простые целые числа. На рисунке 1 приведен пример этого закона. Рис. 1. Иллюстрация закона объемных отношений. Эти законы Гей-Люссака были объяснены в 1811 году итальянским физиком Амадео Авогадро. Закон Авогадро – это один из самых важных законов химии (сформулирован Амадео Авогадро в 1811г), гласящий, что «в равных объемах разных газов, которые взяты при одинаковом давлении и температуре, содержится одинаковое число частиц». Если вы посмотрите на рисунок 2, то увидите пример закона Авогадро. Рис. 2. Иллюстрация закона Авогадро. А теперь давайте попробуем определить, что такое постоянная Авогадро. Для этого определим количество атомов водорода, кислорода и углерода. а) H-водород Ан= 1а.е.м. 1а.е.м = 1,66*10-24г Теперь подсчитаем количество атомов водорода в 1 г. Nн= 1г / (1,66*10-24) г = 6,02*1023 б) O-кислород Ао= 16а.е.м = 16*1.67* 10-24 г No= 16г / (16 *1.66 * 10-24) г =6,02 * 1023 в) C-углерод Ас= 12а.е.м = 12*1.67*10-24 г Nc= 12г / (12* 1.66*10-24) г = 6,02*1023 Вы видите, что если мы возьмем массу вещества, равную атомной массе по величине, но взятую в граммах, то для любого вещества там всегда будет 6.02 *1023 атомов этого вещества. Nа = 6,02*1023 - число или постоянная Авогадро. Понятие моль и значение постоянной Авогадро описывается в видео:
Следствия закона Авогадро.Из закона Авогадро вытекают 2 следствия: 1. Один моль любого газа занимает одинаковый объем при одинаковых условиях. В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона (Рисунок 3). Рис. 3. Уравнение Менделеева-Клапейрона. Давайте посмотрим видео, в котором это следствие доказывается:
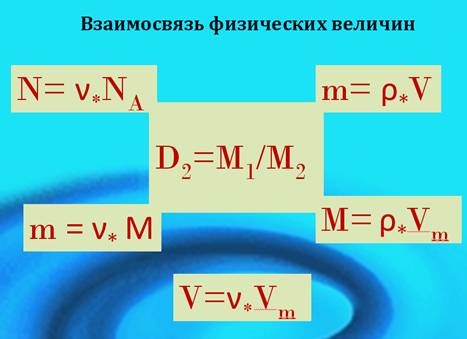
Молярный объем газа при нормальных условиях - фундаментальная физическая постоянная, широко используемая в химических расчетах. Она позволяет применять объем газа вместо его массы. Значение молярного объема газа при н.у. является коэффициентом пропорциональности между постоянными Авогадро и Лошмидта (Рисунок 4) Рис. 4. Значение молярного объема газа при н.у. 2. Молярная масса первого газа равна произведению массы молярной второго газа на относительную плотность по второму первого газа. Это положение имело огромное значение для развития химии, т.к. оно дало возможность определять частичный вес тел, которые способны переходить в парообразное или газообразное состояние. Следовательно, отношение массы определенного объема одного газа к массе такого же объема другого газа, взятого при тех же условиях, называется плотностью первого газа по второму (Рисунок 5). Рис. 5. Плотность первого газа по второму. На рисунке 6 представлена взаимосвязь физических величин: Рис. 6. Взаимосвязь физических величин
Решение задач.На рисунке 7 показаны примеры решения задач, связанных с молярным объемом газов и законом Авогадро. Рис. 7. Пример решения задачи на определение массы газа. Давайте решим еще одну задачу. Дано: V(CH4)=2 л. Найти V(CO2). Решение: 1) Запишите уравнение химической реакции и над и под формулами проставьте исходные данные, соответствующие уравнению реакции: 2 л x л CH4 + 2O2 = CO2 + 2H2O 1 объем 1 объем 1л 1 л 2) Вычислите объем углекислого газа, выделившегося в результате реакции: 1 л CH4 --- 1 л CO2 2 л CH4 --- х л CO2 2 л/1 л = х л/1 л; х = 2 л. Ответ: V(CO2)=2 л.
Выводы1. Закон Авогадро гласит - в равных объемах разных газов, которые взяты при одинаковом давлении и температуре, содержится одинаковое число частиц. 2. Постоянная Авогадро имеет величину 6.02 *1023. 3. Из закона Авогадро вытекает два следствия: один моль любого газа занимает одинаковый объем при одинаковых условиях; молярная масса первого газа равна произведению массы молярной второго газа на относительную плотность по второму первого газа. 4. При нормальных условиях 1 моль газа имеет объем 22,4 л.
Контролирующий блок.1. Что такое молярный объем газа? 2. Сформулируйте закон Авогадро. 3. Как найти постоянную Авогадро и чему она равна? 4. сформулируйте следствия закона Авогадро. 5. Чему равен объем 1 моль газа при нормальных условиях? 6. Как найтимолярный объем газа?
Домашнее задание.1. Рассчитайте, какой объем занимают 5 моль аммиака при нормальных условиях. 2. Определите, какой объем занимают 1,204 • 1023 молекул кислорода при нормальных условиях.
Список литературы:1. Урок на тему «Закон Авогадро» Давыдова И.В., учитель химии, АНО МОУ СОШ №6, г.Краснокамск, Пермский край. 2. Урок на тему «Молярный объем газов» Баженов А.А., учитель химии, МОУ Охтеурская ОСШ. 3. И.С.Москалёва "Решаем и играем": ж-л "Химия в школе", №1, 2008.
Над уроком работали: Давыдова И.В. Баженов А.А. Борисенко И.Н.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: