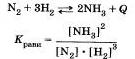|
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Обратимость химических реакций. Химическое равновесие
Театра вы знаете, что реакция может идти при благоприятном соотношении энергетического и энтропийного факторов. Но
если эти факторы уравновешивают друг друга, состояние системы не меняется. В таких случаях говорят, что системи находится в равновесии.
Химические реакции, протекающие в одном направлении, называют необритимыми.
Большинство химических реакций являются обритимыми. Эта значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах).
Taк как со временем концентрации веществ уменьшается, то и скорость прямой реакции тоже уменьшается.
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обдотной реакций станут равными V-> = <-V.
Состояние системы, при котором скорость прямой реакции равна скорости обратной рекции, называют химическим равновесием.
При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом же деле в прямой, и обратный процесс продолжают идти, но с равной скоростью. Поэтому такое равновесие в системе называют подвижным или динамическим.
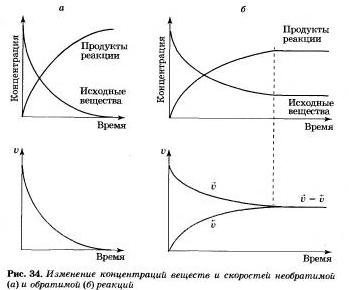
Разницу в изменении концентраций веществ и скорости реакции в случае необратимой и обратимой реакций вы можете увидеть на рисунке 34.
Конгтакты равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной температуре.
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания. В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе.
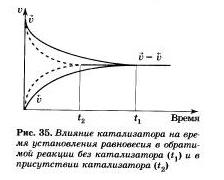
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
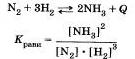
Влияние изменения концентрации веществ
При добавлении в реакционную смесь азота N2 и водорола H2 увеличивается концентрация газов, а значит, увеличивается скорость прямой реакции. Равновесие смещается вправо, в сторону продукта реакции, то есть в сторону аммиака.
Таким образом в реакционной смеси увеличится количество продукта реакции.
Увеличение же концентрации продукта реакции аммика, приведет к смещению равновесия влево, в сторону образования исходных веществ. Этот вывод можно сделать на основании аналогичных рассуждений.
Влияние изменения давления
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии. При увеличении давления уменьшается объем газон, а значит, увеличивается их концентрация.
Предположим, что давление в замкнутой системе повысили, это значит, что концентрации всех газообразных веществ в рассматриваемой нами реакции возрастут в 2 раза.
Изменение давления практически не сказывается на объеме жидких и твердых веществ, то есть не изменяет их концентрацию. Следовательно, состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Влияние изменения температуры
При повышении температуры, как вы знаете, скорости всех реакций (экзо и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (в нашем примере эндотермической) увеличится сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье (1884 г.):
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смешается в ту сторону, которая ослабляет данное воздействие.
Сделаем выводы:
• при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
• при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
• при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
•при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
• при понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производство важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход желаемого вещества.
1. В каком направлении сместится химическое равновесие в следующих системах: а) при понижении температуры; б) при оовышенни давления:
1)2СО + 2СO2 + Q 3)С2Н10 <->С4Н8+ Н2 - Q 2) N2+O2 <->2NO - Q
2. Как повлияет повышение давления ни химическое равновесие в следующих системах:
1) 2NO <-> N2O4 3) Нг2 + Вг2 <-> 2НВг
2) СО <-> Сl2 <-> СОСl2 4) СО + ЗНг <-> СН2 + Н2О(г)
3. Как надо изменить концентрации веществ, давление и температуру гомогенной системы
РСl5 <-> РСl3 + Сl2 - 129 кДж. чтобы сместить равновесие в сторону разложения РСl5?
4. В каком направлении сместится химическое равновесие системы 2СО + 2Н2 <-> СН4 + С02, если концентрации всех веществ уменьшить в 2 раза?
учебники основные и дополнительные по химии, замена устаревших знаний новыми для 11 класса, шпаргалки для учеников
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|