|
План-конспект уроку з курсу “Природознавство” з теми “Різноманітність речовин”
Мета уроку:
Освітня: закріпити поняття “речовина”, “атом”, “молекула”, “дифузія”; пригадати відомості про будову атома, хімічні елементи, утворення молекул; навчити розрізняти прості й складні, органічні та неорганічні речовини.
Виховна: формувати основні світоглядні ідеї про єдність матеріального світу та багатоманітність його форм; сприяти формуванню охайності в роботі, дотриманню правил техніки безпеки.
Розвиваюча: розвивати логічне мислення школярів, уміння порівнювати, використовувати опорні знання та життєвий досвід для опанування новими знаннями, робити висновки, аргументовано доводити свою точку зору; розвивати зацікавленість природничими науками, вносячи у зміст уроків елементи історичного та пізнавального характеру.
Тип уроків: комбіновані
Обладнання:
1. підручник
2. авторська презентація уроку ppt «Різноманітність речовин»
3. робочий зошит
4. картки “Хімічні символи”
5. об’ємні моделі молекул
Хід уроку
Зміст матеріалу уроку
І. Організація класу
ІІ. Повторення вивченого матеріалу
Питання для опитування:
1. Наведіть приклади різних тіл, виготовлених з однієї речовини.
2. З чого складаються речовини?
3. Що таке атом? Яку він має будову?
4. Що таке хімічний елемент?
5. З чого складаються молекули?
6. Дайте визначення явищу дифузії. Чому вона відбувається?
Письмове опитування. Програмований контроль
Повторення хімічних символів за допомогою карток, на яких вони надруковані. Учитель називає хімічні елементи. Учні знаходять їх хімічні символи та підносять карти з їх зображенням.
Гра «Морський бій». У відповідних комірках, які вчитель називає за літерою та цифрою, учні вписують символи хімічних елементів
А Б В
1
2
3
Питання:
І варіант ІІ варіант
1 А-1 Кисень (оксисен) 1 А-1 Азот (нітроген)
2 В-3 Сірка (сульфур) 2 В-3 Вуглець (карбон)
3 Б-2 Залізо (ферум) 3 Б-2 Срібло (арґентум)
4 А-2 Мідь (купрум) 4 А-2 Фосфор
5 В-1 Водень (гідроген) 5 В-1 Хлор
6 А-3 Золото (аурум) 6 А-3 Кисень (оксисен)
7 Б-1 Кремній (силіцій) 7 Б-1 Натрій
8 В-2 Вуглець (карбон) 8 В-2 Водень (гідроген)
9 Б-3 Ртуть (меркурій) 9 Б-3 Залізо (ферум)
Відповіді:
І варіант
А Б В
1 О Si H
2 Cu Fe C
3 Au Hg S
ІІ варіант
А Б В
1 N Na Cl
2 P Ag H
3 O Fe C
ІІІ. Вивчення нового матеріалу
П л а н:
1. Поширення хімічних елементів на Землі.
2. Молекулярна та немолекулярна будова речовин.
3. Прості й складні речовини.
4. Органічні та неорганічні речовини.
1. Поширення хімічних елементів на Землі.
Поширені у природі хімічні елементи не однаково. У земній корі (за масою) переважать Оксиген (47%), Силіцій (27,6%) та Алюміній (8,8%). Речовини, до складу яких вони входять, добре відомі. Так, з атомів Алюмінію та Оксигену утворена глина. Річковий пісок складається з атомів Силіцію та Оксигену. «Абсолютний чемпіон» Оксиген є також у складі води, кисню та тіл живих істот.
У морській воді основними хімічними елементами є Оксиген (85,8%) та Гідроген (10,7%). У ній також є Хлор, Натрій, Сульфур, Магній (3,5%).
В атмосферному повітрі переважають Нітроген (78%) та Оксиген (21%).
В організмі людини – Оксисен (62%), Карбон (21%), Гідроген (10%), Нітроген (3%).
У Всесвіті переважають за масою Гідроген (75%) та Гелій (24%). З них складаються зорі.
Пояснення та демонстрування презентації уроку ppt
2. Молекули та немолекулярна будова речовин
Атоми можуть існувати окремо. Проте, частіше вони сполучаючись між собою, можуть утворювати молекули. Проте виявилося, що не всі речовини складаються з молекул. Структурними частинками речовини можуть бути атоми або інші частинки, об'єднані як у молекулярні, так і немолекулярні структури. Наприклад, атоми Сульфуру об'єднуються в молекули з восьми атомів. Останні утворюють кристал, тобто з'єднуються в певній послідовності, утворюючи структуру, що нагадує решітку. У вузлах такої кристалічної решітки містяться восьмиатомні молекули. При цьому утворюється тверда за звичайних умов речовина жовтого кольору, легкоплавка. Це – сірка.
Інший приклад. Атоми Феруму об'єднуються у немолекулярні кристали. Утворюється речовина залізо – метал сріблясто-сірого кольору, з високою температурою плавлення, електро- і теплопровідний.
Вода, кисень, водень, вуглекислий газ, спирт, крохмаль, цукор, жир – речовини молекулярної будови.
Кухонна сіль, річковий пісок, всі метали – речовини немолекулярної будови.
Речовини молекулярної й немолекулярної будови значно відрізняються за своїми властивостями.
Ознака для порівняння Речовина молекулярної будови Речовини немолекулярної будови
Структурні частинки Молекули Атоми або інші частинки
Зв'язок між Слабкий Міцний
структурними частинками
Температура кипіння і плавлення Низькі Високі
Агрегатний стан за
звичайних умов Твердий, рідкий, газоподібний Твердий, кристалічний
Поширення у природі Переважно в органічному світі. Здебільшого у неживій природі.
Входять до складу живих організмів Входять до складу гірських порід, мінералів, металів
Пояснення матеріалу з використання презентації уроку ppt.
3. Прості й складні речовини
Якщо речовина складена з атомів одного хімічного елементу її вважають простою. Наприклад, молекули простих газів складаються з двох атомів одного й того ж хімічного елементу. Наприклад, молекула кисню складається з двох атомів Оксисену. Її хімічна формула – О2. Молекула водню – з двох атомів Гідрогену (H2), азоту – з двох атомів Нітрогену (N2), хлору – з двох атомів Хлору (Cl2).
У природі існує речовина озон (з грецької – той, що пахне), яка захищає Землю від ультрафіолетового опромінення космосу. Це газ синього кольору з різким запахом. Утворюється з О2 при електричних розрадах (під час грози) та під дією ультрафіолетового опромінення. Він складається з трьох молекул Оксисену й має хімічну формулу О3.
Молекули названих речовин мають такий вигляд:
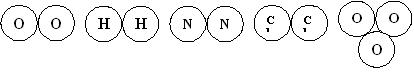
Хімічні формули металів записують, як такі, що складені з одного атому: Fe – залізо, ΑΙ – алюміній, Сu – мідь, Na – натрій (з латини, арабської та грецької – природна сода), Au – золото, Ag – срібло, Hg – ртуть. Також графітові стрижні, вугілля та алмаз складаються лише з атомів Карбону. Їх хімічна формула – С. Різниця у їх властивостях пояснюється різною формою кристалічних ґраток. Всі ці речовини також є простими.
Прості речовини умовно поділяють на метали й неметали. Метали мають немолекулярну будову, добре проводять струм та тепло, є пластичними (легко куються, витягуються у дріт), більшість (крім золота, міді) сірий, або сріблясто-сірий колір, металічний блиск. Неметали можуть мати як молекулярну, та й немолекулярну будову, складені з них погано проводять струм та тепло, крихкі, мають різний колір (фосфор – червоний, сірка – жовтий, графіт – чорний, водень – безбарвний газ).
Якщо речовина складена з атомів кількох хімічних елементів її вважають складною, або хімічною сполукою. Наприклад, вода: H2О. Її структурна формула виглядає так:
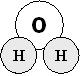
При температурі 2000ОС молекули води розпадаються на два типи атомів: Оксисену та Гідрогену.
Складних речовин у природі значно більше, ніж простих. Це пояснюється тим, що атоми різних хімічних елементів здатні сполучатися один з одним у різній кількості та послідовності, як у мові літери, сполучаючись утворюють різноманітні слова.
Складними речовинами є вуглекислий газ (СО2), кухонна сіль (NaCl), метан (СН4), сульфатна кислота (H2SO4), соляна кислота (HCl), глина (складена переважно з сполуки Al2O3) та безліч інших.
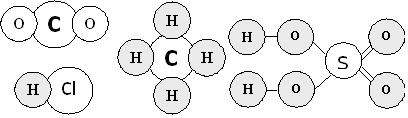
4. Органічні та неорганічні речовини
Речовини також розрізняють органічні та неорганічні.
Органічних речовин у природі найбільше – майже 10 млн. Вони вперше були виявлені у складі живих організмів. Звідси й одержали свою назву. Хоча нині відомо, що ці речовини існують також у неживій природі. Вони всі мають складну молекулярну будову. Основою їх молекули є з’єднані між собою атоми Карбону та зазвичай Гідрогену. Таку будову мають природний газ, нафта, бензин. Досить багато органічних речовин містять ще й атоми Оксигену. Це жири, вуглеводи (крохмаль, цукор), оцет.
Жири й вуглеводи відіграють в організмі роль палива. Вони потрібні для забезпечення організму енергією для життєво важливих процесів: дихання, травлення, пересування у просторі, виконання будь-якої роботи. Найбільш важливими для живих істот є білки. До складу їх молекул входять ще й атоми Нітрогену. Білки є “будівельним” матеріалом для тіл живих організмів. Ми їх одержуємо з їжею: переважно з м’ясом тварин. З молекул Карбону, Гідрогену, Оксисену та Нітрогену складаються також нуклеїнові кислоти, що входять до складу генів, які зберігають й передають з покоління і покоління спадкову інформацію про організм.
Речовини, що не містять атомів Карбону, відносять до неорганічних. Наприклад, вода, кисень, азот, залізо, алюміній. Проте, є неорганічні речовини з атомами Карбону: вугілля, графіт, алмаз, сода, вуглекислий газ. Неорганічних речовин у природі відносно небагато: всього 200 тис. Неорганічні речовини мають частіше немолекулярну будову (метали, мінерали), іноді складаються з молекул (прості гази, вода).
ІІІ. Корекція та перевірка знань
Питання:
1. Наведіть приклади різних тіл, виготовлених з однієї речовини.
2. Поясни причину багатоманітності тіл і речовин.
3. Що таке атом? Яку він має будову?
4. Що таке хімічний елемент?
5. З чого складаються молекули?
6. Яку будову мають немолекулірні речовині?
7. Чим відрізняються прості речовини від складних? Наведи їх приклади.
8. Чим відрізняються органічні речовини від неорганічних? Наведи їх приклади.
ІV. Домашнє завдання
Повторити матеріал з використанням графічного конспекту (шпаргалки).
Надіслано вчителем Міжнародного ліцею "Гранд" Коваленком Р.Р.
Предмети > Природознавство > Природознавство 5 клас > Речовини. Атоми і хімічні елементи. Молекули. Рух молекул. Дифузія. > Речовини. Атоми і хімічні елементи. Молекули. Рух молекул. Дифузія. Конспект уроку і опорний каркас
|













