|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Растворение. Растворимость веществ в воде
Растворы играют очень важную роль в природе, науке к технике. Вода, столь широко распространенная я природе, всегда содержит растворенные вещества. В пресной воде рек и озер их мало, в то время как в морской воде содержится около 3.6% растворенных солей.
В первичном океане (во время появления жизни на Земле) массовая доля солей, по предположениям, была низка, около 1 %.
Именно в этом растворе впервые развились живые организмы, и из ятого рнстнора они получили ноны и молекулы, необходимые дли их роста и жизни... С течением времени живые организмы риз пинались и изменялись. ЧТО позволило им покинуть водную среду и перейти на сушу и затем подняться н воздух. Они приобрели эту способность, сохранин и своих организмах водный раствор в виде жидкостей, содержащих необходимый запас ионов и молекул» — вот так оценивает роль растворов в возникновении и развитии жизни на Земле известный американский химик, лауреат Нобелевской премии Лайнус Полинг Внутри нас, в каждой вашей клеточке — воспоминание о первичном океане, в котором зародилась жизнь, — водном растворе, обеспечивающем саму жизнь.
В каждом живом организме бесконечно течет по сосудам — артериям, венам и капиллярам — волшебный раствор, составляющий основу крови, массовая доля солей в нем такая же, как в первичном океане. — 0,0%. Сложные физико-химические процессы, происходящие в организмах человека и животных, также протекают в растворах. Усвоение нищи связано с переводом питательных веществ в раствор. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Многие технологические процессы в химической и других отраслях промышленности, например получения соды, удобрений, кислот, металлов, бумаги, протекают в растворах. Изучение свойств растворов занимает очень важное место в современной науке. Так что же такое раствор?
Отличие раствора от других смесей в том. что частицы составных частей распределяются в нем равномерно, и в любом микрообъеме такой смеси состав одинаков.
Поэтому под растворами понимали однородные смеси, состоящие из двух или более однородных частей. Это представление исходило пз физической теории растворов.
Сторонники физической теории растворов, которую развивали Вант Гофф, Лррениус и Оствальд, считали, что процесс растворения является результатом диффузии, то есть проникновения, растворенного вещества в промежутки между молекулами воды.
В противоположность представлениям физической теории растворов. Д. И. Менделеев и сторонники химической теории растворов доказывали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды. Поэтому правильнее (точнее) определять раствор как однородную систему, состоящую из частиц растворенною вещества, растворителя и продуктов их взаимодействия.
В результате химического взаимодействия растворенного вещества с водой образуются соединения гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как тепловые явления при растворении. Например, вспомните, что растворение серной кислоты в воде протекает с выделением такого большого количества теплоты, что раствор может закипеть, а потому льют кислоту в воду (а не наоборот). Растворение других веществ, например хлорида натрия, нитрата аммония, сопровождается поглощением теплоты.
М. В. Ломоносов установил, что растворы замерзают при более низкой температуре, чем растворитель. В 1764 г. он писал: "Морозы соленого рассолу не могут в лед превратить удобно, как одолевают пресного".
Гидраты — это непрочные соединения, существующие в растворе- Косвенным доказательством гидратации является существование твердых кристаллогидратов — солей, в состав которых входит вода. Ее в этом случае называют кристаллизационной. Например, к кристаллогидратам относится хорошо известная сачь голубого цвета — медный кунорос СиЗО, 5НгО. Безводный сульфат меди (И) — кристаллы белого цвета. Изменение цвета сульфата меди на голубой ири растворении его в воде и существование голубых кристаллов медного купороса является еще одним доказательством гидратной теории Д. И Менделеева.
В настоящее время принята теория, которая объединяет обе точки зрения, — физико-химическая теория растворов. Ее предсказывал еще в 1906 г. Д. И. Менделеев в своем замечательном учебнике "Основы химии": «Две указанные стороны растворения и гипотезы, до сих пор приложенные к рассмотрению растворов, хотя имеют отчасти различные исходные точки, но без всякого сомнения, по всей вероятности, приведут к общей теории растворов, потому что одни общие законы управляют как физическими, так и химическими явлениями».
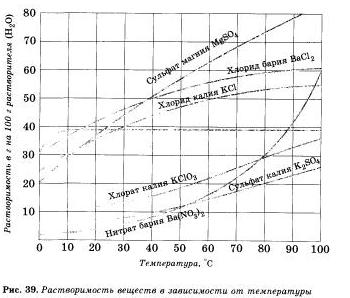
Растворимость веществ в воде зависит от температуры. Как правило, растворимость твердых веществ в воде увеличивается с повышением температуры, а растворимость ионов — уменьшается, поэтому волу можно почти полностью освободить от растворенных в ней газов кипячением. Если растворять в воде хлорид калия КО. применяющийся как удобрение, то при комнатной температуре (20 ºС) может раствориться только 34,4 г соли в 100 г воды; сколько бы не перемешивали раствор с остатком нерастворивгаейся соли, больше соли не растворится — раствор будет насыщен этой солью при данной температуре.
Насыщенным называется такой раствор, в котором при данной температуре вещество больше не растворяется.
Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Ненасыщенным называется такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадет в осадок, то образуется пересыщенный раствор.
Пересыщенным называется такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, нем в его насыщенном растворе при тех же условиях.
Некоторыг вещества сравнительно легко дают пересыщенные растворы. К ним относятся, например, кристаллогидраты — глауберова соль и медный купорос.
Пересыщенные растворы готовят так. Приготавливают насыщенный раствор соли при высокой температуре, например при температуре кипения. Избыток соли отфильтровывают, накрывают колбу с горячим фильтратом ватой к осторожно, избегая сотрясений, медленно охлаждают при комнатной температуре. Приготовленный таким образом раствор, предохраняемый от толчков и попадания пыли, может храниться довольно долго. Но стоит только в такой пересыщенный раствор внести стеклянную палочку, на кончике которой имеется несколько крупинок этой соли, как немедленно начнется ее кристаллизация из раствора.
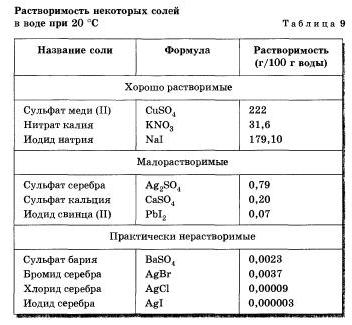
Глауберова соль широко используется в качестве сырья на химических заводах. Добывают ее энной в заливе Кара-Богаз-Гол, который сравнительно изолирован от Каспийского моря. Летом из-за высокой Скорости испарения воды шин заполняется сильно концентрированным раствором соли. Зимой, в связи с понижением температуры, растворимость ее уменьшается и соль кристаллизуется, что н лежит в основе се добычи. Летом кристаллы соли растворяются и добыча ее прекращается. При работе с различными веществами важно шать их рас-творимоегь в воде. Вещество считается хорошо растворимым, если при комнатной температуре в 100 г воды растворяется больше 1 г »гого вещества. Если при таких условиях растворяется меньше 1 г вещества в 100 г воды, то такое вещество считается малорастяоримым. К веществам практически нерастворимым относятся такие, растворимость которых меньше 0,01 г в 100 г воды.
Совершенно нерастворимых веществ в природе ие существует. Например, даже атомы серебра и золота чуть-чуть переходят в раствор. Как известно, растворы золота или серебра в воде убивают микробов.
1. Растворы.
2. Физическая и химический теории пасторов.
3. Тепловые явления при растворений.
4. Гидраты и кристаллогидраты; кристаллизационная вода
5. Насыщенные, ненасыщенные н пересыщенные растворы
6. Хорошо растворимые, чалорастноричые и практически нерастворимые вещества.
Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
Почему аквариумы нельзя заполнять быстро охлажденной прокипяченной водой (они должна постоять несколько дней)?
Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
Пользуясь рисунком 39, определите массовую долю хлорида калия, содержащегося в насыщенном растворе при 20 °С.
Может ли разбавленный раствор быть одновременно п насыщенным?
К 500 г насыщенного при 20 °С раствора сульфита магния прилили достаточный для проведения реакции объем раствора хлорида бария. Найдите массу выпавшего осадка.
статьи по химии, рефераты по химии для 8 класса, конспекты уроков по всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|