|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Скорость химических реакций<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Скорость химических реакций</metakeywords>''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Скорость химических реакций<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Скорость химических реакций</metakeywords>''' |
| | | | |
| - | Мы уже познакомились с основными типами химических реакций, научились отличать их от физических явлений по определенным признакам, производить расчеты по химическим уравнениям. Мы убедились, что свойства веществ, вступивших в реакцию, отличаются от свойств образовавшихся веществ.<br>Однако настало время поговорить о продолжительности химических реакций, то есть о протекании химического процесса во времени, за которое он происходит. Известно, что одни химические реакции протекают за малые доли секунды, другие же — за минуты, часы, дни. Например, практически мгновенно протекают реакции, которые сопровождаются взрывным эффектом: горение пороха, воспламенение горючей смеси в двигателе внутреннего сгорания автомобиля. При сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария:<br> | + | Мы уже познакомились с основными типами химических реакций, научились отличать их от [[Физические_явления_в_химии|физических явлений]] по определенным признакам, производить расчеты по химическим уравнениям. Мы убедились, что свойства веществ, вступивших в реакцию, отличаются от свойств образовавшихся веществ.<br>Однако настало время поговорить о продолжительности [[Классификация_химических_реакций|химических реакций]], то есть о протекании химического процесса во времени, за которое он происходит. Известно, что одни химические реакции протекают за малые доли секунды, другие же — за минуты, часы, дни. Например, практически мгновенно протекают реакции, которые сопровождаются взрывным эффектом: горение пороха, воспламенение горючей смеси в двигателе внутреннего сгорания автомобиля. При сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария:<br> |
| | | | |
| - | [[Image:him8-96.jpg]] | + | [[Image:Him8-96.jpg|формула]] |
| | | | |
| | <br>Наоборот, реакция ржавления железа (коррозия) идет так медленно, что проследить за ее результатами можно лишь по истечении длительного времени. | | <br>Наоборот, реакция ржавления железа (коррозия) идет так медленно, что проследить за ее результатами можно лишь по истечении длительного времени. |
| | | | |
| - | Одна и та же реакция может в одних условиях протекать быстро, а в других — медленно. Например, процесс окисления серебра или меди на воздухе тянется годами, а в присутствии озона проходит чрезвычайно быстро. Чтобы характеризовать быстроту течения химической реакции, пользуются понятием скорость химической реакции, которая обозначается латинской буквой ''v''.<br> | + | Одна и та же реакция может в одних условиях протекать быстро, а в других — медленно. Например, процесс окисления серебра или меди на воздухе тянется годами, а в присутствии озона проходит чрезвычайно быстро. Чтобы характеризовать быстроту течения химической реакции, пользуются понятием скорость химической реакции, которая обозначается латинской буквой ''v''.<br> |
| | | | |
| - | <u>''Скорость химической реакции определяется''</u> изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.<br> | + | <u>''Скорость химической реакции определяется''</u> изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.<br> |
| | | | |
| - | Запишем формулу, по которой можно найтн скорость реакции: | + | Запишем формулу, по которой можно найтн скорость реакции: |
| - | | + | |
| - | [[Image:him8-97.jpg]]
| + | |
| | | | |
| | + | [[Image:Him8-97.jpg|формула]] |
| | | | |
| | + | <br> |
| | | | |
| | где с2 и с1 — молярные концентрации реагирующих или образующихся веществ, соответственно, в момент времени t2, t1. Если скорость реакции характеризуют изменением молярной концентрации исходных (реагарующих) веществ, то t2>t1, а с2<с1 (концентрация исходного вещества убывает по мере протекания реакции). Так как скорость реакции имеет положительное значение, перед дробью следует поставить знак минус. | | где с2 и с1 — молярные концентрации реагирующих или образующихся веществ, соответственно, в момент времени t2, t1. Если скорость реакции характеризуют изменением молярной концентрации исходных (реагарующих) веществ, то t2>t1, а с2<с1 (концентрация исходного вещества убывает по мере протекания реакции). Так как скорость реакции имеет положительное значение, перед дробью следует поставить знак минус. |
| | | | |
| - | <br>Количество вещества в единице объема называется его молярной концентрацией. Она измеряется в моль/л. Так как время измеряется в секундах (минутах, часах), то можно вывести и единицы измерения скорости химической реакции: 1 моль/л * с; 1 кмоль/м3 • мин и т. д. | + | <br>Количество вещества в единице объема называется его [[Молярный_объем_газов._Полные_уроки|молярной]] концентрацией. Она измеряется в моль/л. Так как время измеряется в секундах (минутах, часах), то можно вывести и единицы измерения скорости химической реакции: 1 моль/л * с; 1 кмоль/м3 • мин и т. д. |
| | | | |
| - | <br>Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать: а) какое количество вещества образуется (для продукта реакции) или расходуется (для исходного вещества); б) за какое время это происходит и в) в каком объеме протекает реакция. | + | <br>Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать: а) какое количество вещества образуется (для продукта реакции) или расходуется (для исходного вещества); б) за какое время это происходит и в) в каком объеме протекает реакция. |
| | | | |
| - | <br>Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта и, в конечном итоге, зарплата работников и себестоимость продукции. | + | <br>Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в [[Химическая_промышленность|химической промышленности]] от скорости химической реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта и, в конечном итоге, зарплата работников и себестоимость продукции. |
| | | | |
| - | <br>Раздел химии, изучающий скорость химической реакции, называется жылшческой кинетикой. Зная ее законы, человек получает возможность управлять химическими процессами, им требуемую скорость.<br> | + | <br>Раздел химии, изучающий скорость химической реакции, называется жылшческой кинетикой. Зная ее законы, человек получает возможность управлять химическими процессами, им требуемую скорость.<br> |
| | | | |
| - | При рассмотрении вопросa о скорости реакции необходимо помнить, что реакции в химии делятся на гомогенные и гетерогенные. Реакции, которые протекают в однородной среде (нет поверхности раздела реагирующих веществ), например в си газов или в растворах, называются гомогенными (от греч. голо — «равный, одинаковый»). Гетерогенными называются реакции, которые идут между веществами в неоднородной среде (есть поверхность раздела реагирующих веществ). Например. На поверхности соприкосновения твердого вещества и жидкости, газа и жидкости, твердого вещества и газа и т. д. (от греч. гетеро - «разный, другой»). | + | При рассмотрении вопросa о скорости реакции необходимо помнить, что реакции в [[Хімія|химии]] делятся на гомогенные и гетерогенные. Реакции, которые протекают в однородной среде (нет поверхности раздела реагирующих веществ), например в си газов или в растворах, называются гомогенными (от греч. голо — «равный, одинаковый»). Гетерогенными называются реакции, которые идут между веществами в неоднородной среде (есть поверхность раздела реагирующих веществ). Например. На поверхности соприкосновения твердого вещества и жидкости, газа и жидкости, твердого вещества и газа и т. д. (от греч. гетеро - «разный, другой»). |
| | | | |
| - | <br>Данное выше определение и соответствующая ему формула скорости химической реакции справедливы для гомогенных реакций. | + | <br>Данное выше определение и соответствующая ему формула скорости химической реакции справедливы для гомогенных реакций. |
| | | | |
| - | <br>Если реакция гетерогенная, то она может идти только на поверхности раздела реагирующих веществ. В этом случае скорость химической реакции Йудет определяться площадью поверхности соприкосновения реагирующих веществ. | + | <br>Если реакция гетерогенная, то она может идти только на поверхности раздела реагирующих веществ. В этом случае скорость химической реакции Йудет определяться площадью поверхности соприкосновения реагирующих веществ. |
| | | | |
| - | <br>Следовательно, для гетерогенных реакций одним Из факторов, которые определяют скорость химической реакции, является величина площади поверхности соприкосновения реагирующих веществ. Поэтому на производстве столь часто проводятся химические реакции в "кипящем слое". Твердое вещество для этой цели мелко дробят. Измельчают почти до состояния пыли, а затем черед него пропускают снизу второе вещество, как правило, газ. Прохождение его через мелкораздробленное первое вещество-peaгент сопровождается иллюзией кипения. Например, в «кипящем слое» осуществляется обжиг мелко измельченного серного колчедана при производстве серкой кислоты. | + | <br>Следовательно, для гетерогенных реакций одним Из факторов, которые определяют скорость химической реакции, является величина площади поверхности соприкосновения реагирующих веществ. Поэтому на производстве столь часто проводятся химические реакции в "кипящем слое". Твердое вещество для этой цели мелко дробят. Измельчают почти до состояния пыли, а затем черед него пропускают снизу второе вещество, как правило, газ. Прохождение его через мелкораздробленное первое вещество-peaгент сопровождается иллюзией кипения. Например, в «кипящем слое» осуществляется обжиг мелко измельченного серного колчедана при производстве серкой кислоты. |
| | | | |
| - | <br>В лабораторных условиях зависимость скорости гетерогенной реакции от величины поверхности соприкосновения реагирующих веществ можно наблюдать на следующем опыте. | + | <br>В лабораторных условиях зависимость скорости гетерогенной реакции от величины поверхности соприкосновения реагирующих веществ можно наблюдать на следующем опыте. |
| | | | |
| - | <br>Опустите в одну пробирку гранулу цинка, а во вторую — порошок цинка такой же массы. Налейте в обе пробирки по 2 мл раствора соляной кислоты. В какой из пробирок реакция идет быстрее? | + | <br>Опустите в одну пробирку гранулу цинка, а во вторую — порошок цинка такой же массы. Налейте в обе пробирки по 2 мл раствора соляной [[Кислоты._Полные_уроки|кислоты]]. В какой из пробирок реакция идет быстрее? |
| | | | |
| - | <br>Другие факторы, от которых зависит скорость химической реакции, мы рассмотрим далее. | + | <br>Другие факторы, от которых зависит скорость химической реакции, мы рассмотрим далее. |
| | | | |
| | <br>1. Скорость химической реакции. | | <br>1. Скорость химической реакции. |
| Строка 49: |
Строка 49: |
| | 4. Гомогенные и гетерогенные химические реакции. | | 4. Гомогенные и гетерогенные химические реакции. |
| | | | |
| - | 5. Кипящий слой | + | 5. Кипящий слой |
| | | | |
| - | <br>Известно, что для полнот гниения брошенной и лесу газеты потребуется год. для ржавления консервной банки десять лет, а стекло практически не разрушается и в течение столетий. Что можно сказать о скорости названных химических процессов? Какой практический вывод можно сделать из приведенных примеров? | + | <br>Известно, что для полнот гниения брошенной и лесу газеты потребуется год. для ржавления консервной банки десять лет, а стекло практически не разрушается и в течение столетий. Что можно сказать о скорости названных химических процессов? Какой практический вывод можно сделать из приведенных примеров? |
| | | | |
| - | <br>В произведен иях художественной литературы часто встречается выражение «позеленевшая от времени бронзп». Является ли это утверждение верным? Обоснуйте свою точку зрения. | + | <br>В произведен иях художественной литературы часто встречается выражение «позеленевшая от времени бронзп». Является ли это утверждение верным? Обоснуйте свою точку зрения. |
| | | | |
| - | <br>В сосуд вместимостью 3 л была помещена смесь 3 моль кислорода и водорода в отношении 1:2. Через 10 мин количество смеси уменьшилось до 0,6 моль. Какова была скорость реакции? | + | <br>В сосуд вместимостью 3 л была помещена смесь 3 моль [[Кислород|кислорода]] и водорода в отношении 1:2. Через 10 мин количество смеси уменьшилось до 0,6 моль. Какова была скорость реакции? |
| | | | |
| - | <br>Что общего между понятиями скорость движения и скорость химической реакции? | + | <br>Что общего между понятиями скорость движения и скорость химической реакции? |
| | | | |
| - | <br>Приведите примеры гомогенных и гетерогенных реакций из числа рассмотренных вами ранее. | + | <br>Приведите примеры гомогенных и гетерогенных реакций из числа рассмотренных вами ранее. |
| | | | |
| - | <br> <sub>дискуссионные вопросы по [[Химия|химии]], картинки у уроку [[Химия_8_класс|химии 8 класса]], схемы ко [[гипер|всем предметам]]</sub> | + | <br> <sub>дискуссионные вопросы по [[Химия|химии]], картинки у уроку [[Химия 8 класс|химии 8 класса]], схемы ко [[Гипер|всем предметам]]</sub> |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Текущая версия на 05:24, 29 июня 2012
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Скорость химических реакций
Мы уже познакомились с основными типами химических реакций, научились отличать их от физических явлений по определенным признакам, производить расчеты по химическим уравнениям. Мы убедились, что свойства веществ, вступивших в реакцию, отличаются от свойств образовавшихся веществ.
Однако настало время поговорить о продолжительности химических реакций, то есть о протекании химического процесса во времени, за которое он происходит. Известно, что одни химические реакции протекают за малые доли секунды, другие же — за минуты, часы, дни. Например, практически мгновенно протекают реакции, которые сопровождаются взрывным эффектом: горение пороха, воспламенение горючей смеси в двигателе внутреннего сгорания автомобиля. При сливании растворов хлорида бария и серной кислоты мгновенно образуется белый осадок сульфата бария:
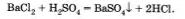
Наоборот, реакция ржавления железа (коррозия) идет так медленно, что проследить за ее результатами можно лишь по истечении длительного времени.
Одна и та же реакция может в одних условиях протекать быстро, а в других — медленно. Например, процесс окисления серебра или меди на воздухе тянется годами, а в присутствии озона проходит чрезвычайно быстро. Чтобы характеризовать быстроту течения химической реакции, пользуются понятием скорость химической реакции, которая обозначается латинской буквой v.
Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
Запишем формулу, по которой можно найтн скорость реакции:
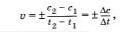
где с2 и с1 — молярные концентрации реагирующих или образующихся веществ, соответственно, в момент времени t2, t1. Если скорость реакции характеризуют изменением молярной концентрации исходных (реагарующих) веществ, то t2>t1, а с2<с1 (концентрация исходного вещества убывает по мере протекания реакции). Так как скорость реакции имеет положительное значение, перед дробью следует поставить знак минус.
Количество вещества в единице объема называется его молярной концентрацией. Она измеряется в моль/л. Так как время измеряется в секундах (минутах, часах), то можно вывести и единицы измерения скорости химической реакции: 1 моль/л * с; 1 кмоль/м3 • мин и т. д.
Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать: а) какое количество вещества образуется (для продукта реакции) или расходуется (для исходного вещества); б) за какое время это происходит и в) в каком объеме протекает реакция.
Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта и, в конечном итоге, зарплата работников и себестоимость продукции.
Раздел химии, изучающий скорость химической реакции, называется жылшческой кинетикой. Зная ее законы, человек получает возможность управлять химическими процессами, им требуемую скорость.
При рассмотрении вопросa о скорости реакции необходимо помнить, что реакции в химии делятся на гомогенные и гетерогенные. Реакции, которые протекают в однородной среде (нет поверхности раздела реагирующих веществ), например в си газов или в растворах, называются гомогенными (от греч. голо — «равный, одинаковый»). Гетерогенными называются реакции, которые идут между веществами в неоднородной среде (есть поверхность раздела реагирующих веществ). Например. На поверхности соприкосновения твердого вещества и жидкости, газа и жидкости, твердого вещества и газа и т. д. (от греч. гетеро - «разный, другой»).
Данное выше определение и соответствующая ему формула скорости химической реакции справедливы для гомогенных реакций.
Если реакция гетерогенная, то она может идти только на поверхности раздела реагирующих веществ. В этом случае скорость химической реакции Йудет определяться площадью поверхности соприкосновения реагирующих веществ.
Следовательно, для гетерогенных реакций одним Из факторов, которые определяют скорость химической реакции, является величина площади поверхности соприкосновения реагирующих веществ. Поэтому на производстве столь часто проводятся химические реакции в "кипящем слое". Твердое вещество для этой цели мелко дробят. Измельчают почти до состояния пыли, а затем черед него пропускают снизу второе вещество, как правило, газ. Прохождение его через мелкораздробленное первое вещество-peaгент сопровождается иллюзией кипения. Например, в «кипящем слое» осуществляется обжиг мелко измельченного серного колчедана при производстве серкой кислоты.
В лабораторных условиях зависимость скорости гетерогенной реакции от величины поверхности соприкосновения реагирующих веществ можно наблюдать на следующем опыте.
Опустите в одну пробирку гранулу цинка, а во вторую — порошок цинка такой же массы. Налейте в обе пробирки по 2 мл раствора соляной кислоты. В какой из пробирок реакция идет быстрее?
Другие факторы, от которых зависит скорость химической реакции, мы рассмотрим далее.
1. Скорость химической реакции.
2. Единицы скорости химической реакции
3. Химическая кинетика.
4. Гомогенные и гетерогенные химические реакции.
5. Кипящий слой
Известно, что для полнот гниения брошенной и лесу газеты потребуется год. для ржавления консервной банки десять лет, а стекло практически не разрушается и в течение столетий. Что можно сказать о скорости названных химических процессов? Какой практический вывод можно сделать из приведенных примеров?
В произведен иях художественной литературы часто встречается выражение «позеленевшая от времени бронзп». Является ли это утверждение верным? Обоснуйте свою точку зрения.
В сосуд вместимостью 3 л была помещена смесь 3 моль кислорода и водорода в отношении 1:2. Через 10 мин количество смеси уменьшилось до 0,6 моль. Какова была скорость реакции?
Что общего между понятиями скорость движения и скорость химической реакции?
Приведите примеры гомогенных и гетерогенных реакций из числа рассмотренных вами ранее.
дискуссионные вопросы по химии, картинки у уроку химии 8 класса, схемы ко всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|










