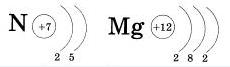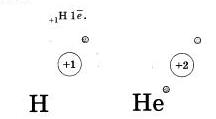|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Строение электронных оболочек атомов'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Строение электронных оболочек атомов</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Строение электронных оболочек атомов'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Строение электронных оболочек атомов</metakeywords> |
| | | | |
| - | Мы выяснили, что сердце атома — это его ядро. Вокруг него располагаются электроны. Они не могут быть неподвижны, так как немедленно упали бы на ядро. | + | Мы выяснили, что сердце атома — это его ядро. Вокруг него располагаются электроны. Они не могут быть неподвижны, так как немедленно упали бы на ядро. |
| | | | |
| - | <br>В начале XX в. была принята планетарная модель строения атома, согласно которой вокруг очень малого по размерам положительного ядра движутся электроны, подобно планетам вокруг Солнца. Дальнейшие исследования показали, что строение атома значительно сложнее. Проблема строения атома остается актуальной и для современной науки. | + | <br>В начале XX в. была принята планетарная модель строения атома, согласно которой вокруг очень малого по размерам положительного ядра движутся электроны, подобно планетам вокруг [[Обжигающее_солнце|Солнца]]. Дальнейшие исследования показали, что строение атома значительно сложнее. Проблема строения атома остается актуальной и для современной науки. |
| | | | |
| - | <br>Элементарные частицы, ядро атома, атом, молекула — все это объекты микромира, не наблюдаемого нами. В нем действуют иные законы, чем в макромире, объекты которого мы можем наблюдать или непосредственно, или с помощью приборов (микроскоп, телесной и т.д.). Поэтому, обсуждая далее строение электронных оболочек атомов, будем понимать, что мы создаем свое представление (модель), которое в значительной степени соответствует современным взглядам, хотя и не является абсолютно таким же, как у ученого-химика. Наша модель упрощена. | + | <br>Элементарные частицы, ядро атома, атом, молекула — все это объекты микромира, не наблюдаемого нами. В нем действуют иные законы, чем в макромире, объекты которого мы можем наблюдать или непосредственно, или с помощью приборов (микроскоп, телесной и т.д.). Поэтому, обсуждая далее строение электронных оболочек атомов, будем понимать, что мы создаем свое представление (модель), которое в значительной степени соответствует современным взглядам, хотя и не является абсолютно таким же, как у ученого-химика. Наша модель упрощена. |
| | | | |
| - | <br>Электроны, двигаясь вокруг ядра атома, образуют в совокупности его злектронную оболочку. Число электронов в оболочке атома равно, как вы уже знаете, числу протонов в ядре атома и определяется порядковым или атомным номером элемента в таблице Д. И. Менделеева. Так, электронная оболочка атома водорода состоит из одного электрона, хлора — из семнадцати, золота - из семидесяти девяти. Как же движутся электроны? Хаотически, подобно мошкам вокруг горящей лампочки? | + | <br>Электроны, двигаясь вокруг ядра [[Атом_і_атомне_ядро._Дослід_Резерфорда._Ядерна_модель_атома|атома]], образуют в совокупности его злектронную оболочку. Число электронов в оболочке атома равно, как вы уже знаете, числу протонов в ядре атома и определяется порядковым или атомным номером элемента в таблице Д. И. [[52._Значення_періодичного_закону._Життя_і_наукова_дiяльність_Д._І._Менделєєва|Менделеева]]. Так, электронная оболочка атома водорода состоит из одного электрона, хлора — из семнадцати, золота - из семидесяти девяти. Как же движутся электроны? Хаотически, подобно мошкам вокруг горящей лампочки? |
| | | | |
| - | <br>Или же в каком-то определенном порядке? Оказывается, именно в определенном порядке. | + | <br>Или же в каком-то определенном порядке? Оказывается, именно в определенном порядке. |
| | | | |
| - | <br>Электроны а атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие — слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним, и их труднее вырвать из электронной оболочки, а вот чем дальше они от ядер, тем легче их оторвать. Очевидно, что по мере удаления от ядра атома запас энергии электрона увеличивается. | + | <br>Электроны а атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие — слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним, и их труднее вырвать из электронной оболочки, а вот чем дальше они от ядер, тем легче их оторвать. Очевидно, что по мере удаления от ядра атома запас энергии электрона увеличивается. |
| | | | |
| - | [[Image:him8-20.jpg]] | + | [[Image:Him8-20.jpg|химия]] |
| | | | |
| - | <br>Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются здектронные слои в электронной оболочке атома. Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями. Мы далее так и будем говорить: Электрон находится на определенном энергетическом уровне. | + | <br>Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются здектронные слои в электронной оболочке атома. Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями. Мы далее так и будем говорить: Электрон находится на определенном энергетическом уровне. |
| | | | |
| - | <br>Число энергетических уровней равно номеру периода в таблице Д. И. Менделеева, в котором находится химический элемент. Значит, электронная оболочка атомов первого периода содержит один энергетический уровень, второго период — два, третьего — три и т. д. Например, в атоме азота оно состоит из двух энергетических уровней, а в атоме магния - из трех:<br> [[Image:him8-21.jpg]]<br> | + | <br>Число энергетических уровней равно номеру периода в таблице Д. И. Менделеева, в котором находится химический элемент. Значит, электронная оболочка атомов первого периода содержит один энергетический уровень, второго период — два, третьего — три и т. д. Например, в атоме азота оно состоит из двух энергетических уровней, а в атоме магния - из трех:<br> [[Image:Him8-21.jpg|химия]]<br> |
| | | | |
| - | В курсе химии 8 — 9 классов мы будем рассматривать елементи только первых трех периодов, поэтому с завершенным третьим энергетическим уровнем у атомов мы не встретимся. | + | В курсе [[Хімія_8_клас|химии 8]] — 9 классов мы будем рассматривать елементи только первых трех периодов, поэтому с завершенным третьим энергетическим уровнем у атомов мы не встретимся. |
| | | | |
| - | <br>Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.<br>Теперь мы можем составить схемы строении электронных оболочек атомов, руководствуясь следующим планом: | + | <br>Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.<br>Теперь мы можем составить схемы строении электронных оболочек атомов, руководствуясь следующим планом: |
| | | | |
| - | <br>а) определим общее число электронов на оболочке по порядковому номеру элемента;<br>б) определим число энергетических уровней в электронной оболочке по номеру периода;<br>в) определим число электронов на каждом энергетическом уровне (на 1 -м — не больше двух; на 2-м — не более восьми, на<br>внешнем уровне число электронов равно номеру группы — для элементов главных подгрупп). | + | <br>а) определим общее число электронов на оболочке по порядковому номеру элемента;<br>б) определим число энергетических уровней в электронной оболочке по номеру периода;<br>в) определим число электронов на каждом энергетическом уровне (на 1 -м — не больше двух; на 2-м — не более восьми, на<br>внешнем уровне число электронов равно номеру группы — для элементов главных подгрупп). |
| | | | |
| - | <br>Ядро атома водорода имеет заряд (+1). то есть содержит только олив протон, соответственно только один алектров на единственном энергетическом уровне. Схематично это представлено ниже, записывается с помощью электронной формулы следующим образом:<br>[[Image:him8-22.jpg]] | + | <br>Ядро атома водорода имеет заряд (+1). то есть содержит только олив протон, соответственно только один алектров на единственном энергетическом уровне. Схематично это представлено ниже, записывается с помощью электронной формулы следующим образом:<br>[[Image:Him8-22.jpg|химия]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Следующий элемент I периода гелий. [[Тема_20._Структура_і_функції_ядра._Каріотип.|Ядро]] атома гелия имеет заряд (+2). V него ва энергетическом уровне имеются уже два электрона:<br> <br>На первом энергетическом уровне могут поместиться только два электрона и никак ве больше — он полностью завершен. Потому-то I период системы Менделеева и состоит из двух элементов.<br>[[Image:Him8-23.jpg|химия]] |
| | | | |
| - | Следующий элемент I периода гелий. Ядро атома гелия имеет заряд (+2). V него ва энергетическом уровне имеются уже два электрона:<br> <br>На первом энергетическом уровне могут поместиться только два электрона и никак ве больше — он полностью завершен. Потому-то I период системы Менделеева и состоит из двух элементов.<br>[[Image:him8-23.jpg]]
| + | <br> |
| | | | |
| | + | У атома лития, элемента II периода, появляется еще один энергетический уровень, на который отправится третий электрон: |
| | | | |
| | + | [[Image:Him8-24.jpg|химия]] |
| | | | |
| - | У атома лития, элемента II периода, появляется еще один энергетический уровень, на который отправится третий электрон:
| + | <br> |
| | | | |
| - | [[Image:him8-24.jpg]]
| + | У атома бериллия на второй уровень попадает, еще одни электрон: |
| | | | |
| | + | [[Image:Him8-25.jpg|химия]] |
| | | | |
| | + | <br> |
| | | | |
| - | У атома бериллия на второй уровень попадает, еще одни электрон:
| + | Атом бора на внешнем уровне имеет три электрона, а атом углерода — четыре электрона; атом фтора — семь электронов, атом неона — восемь электронов. |
| | | | |
| - | [[Image:him8-25.jpg]]
| + | Второй уровень может вместить только восемь электронов, в поэтому ов завершен у неона. |
| | | | |
| | + | [[Image:Him8-26.jpg|химия]] |
| | | | |
| | + | <br> |
| | | | |
| - | Атом бора на внешнем уровне имеет три электрона, а атом углерода — четыре электрона; атом фтора — семь электронов, атом неона — восемь электронов.
| + | У атома натрия, элемента III периода, появляется третий энергетический уровень (обратите внимание — атом элемента III периода содержит три энергетических уровни)), и на нем находится один электрон. |
| | | | |
| - | Второй уровень может вместить только восемь электронов, в поэтому ов завершен у неона.
| + | <br> |
| | | | |
| - | [[Image:him8-26.jpg]]
| + | Будем внимательными: натрий — элемент 1 группы, на внешнем энергетическом уровне у него один электрон. |
| | | | |
| | + | <br>Очевидно, нетрудно будет записать строение энергетических уровней для атома серы, элемента VI группы III периода. |
| | | | |
| | + | [[Image:Him8-27.jpg|формула]] <br> Атомы элементов IV периода конечно же имеют четвертый уровеннь. |
| | | | |
| - | У атома натрия, элемента III периода, появляется третий энергетический уровень (обратите внимание — атом элемента III периода содержит три энергетических уровни)), и на нем находится один электрон.
| + | <br>Начнем с аналогии. Подобно тому как быстро движущаяся игла швейной машинки, пронзая ткань, вышивает на ней узор, так и неизмеримо быстрее движущийся в пространстве вокруг атомного ядра электрон вышивает, только не плоский, а объемный рисунок электронного облика — орбитали. Таи как скорость движения электрона в сотни тысяч раз больше скорости движения швейной иглы, то говорят о вероятности нахождения электрона в том или миом месте пространства. Допустим, что вам удалось, как на спортивном фотофинише, установить положение электрона в каком-то месте около ядра и отметить это положение точкой. Если такой фотофиниш сделать сотни, тысячи ряд, то получится модель электронного облака. |
| | | | |
| | + | <br>В зависимости от энергии электронные облака, или орбитали. отличаются размерами. Понятно, что чем меньше запас энергии электрона, тем сильнее притягивается он к ядру и тем меньше по размерам его орбиталь. |
| | | | |
| | + | <br>Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона или электронным облаком.<br> |
| | | | |
| - | Будем внимательными: натрий — элемент 1 группы, на внешнем энергетическом уровне у него один электрон.
| + | Мы можем изобразить строение атомов более полными электронными формулами.<br>Запишем электронные формулы атомов I и II периодов:<br> [[Image:Him8-28.jpg|формула]] |
| | | | |
| - | <br>Очевидно, нетрудно будет записать строение энергетических уровней для атома серы, элемента VI группы III периода. | + | <br>Если элементы имеют одинаково устроевные внешние энергетические уровни, то свойстве этих элементов подобны. Ска жем. аргон н неон содержат на ввешвем уровне по восемт электронов, н потому овн инертны, то есть почти не вступаю) в химические реакции. В свободном виде аргон н неон — газы, которые имеют одноитомные молекулы. |
| | | | |
| - | [[Image:him8-27.jpg]]
| + | <br>Атомы литии, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу Периодической системы. |
| - | <br> | + | |
| - | Атомы элементов IV периода конечно же имеют четвертый уровеннь. | + | |
| | | | |
| - | <br>Начнем с аналогии. Подобно тому как быстро движущаяся игла швейной машинки, пронзая ткань, вышивает на ней узор, так и неизмеримо быстрее движущийся в пространстве вокруг атомного ядра электрон вышивает, только не плоский, а объемный рисунок электронного облика — орбитали. Таи как скорость движения электрона в сотни тысяч раз больше скорости движения швейной иглы, то говорят о вероятности нахождения электрона в том или миом месте пространства. Допустим, что вам удалось, как на спортивном фотофинише, установить положение электрона в каком-то месте около ядра и отметить это положение точкой. Если такой фотофиниш сделать сотни, тысячи ряд, то получится модель электронного облака. | + | <br>Сделаем обобщение; одинаковое строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяют и свойства химических элементов. Эта закономерность отражева в названии Периоды ческой смеявв химических элементов Д. И. Менделеева.<br> <br>Орбитали могут иметь разную форму. Так, каждый новый энергетический уровень в атоме начиняется с а орбитали, которая имеет сферическую форму. На каждой орбитали может находиться только два электрона. Таких орбиталей три. Любую орбиталь занимают не более двух [[Состояние_электронов_в_атоме|электронов]]. Следовательно, на орбитали их может быть только два, а на трех сорбита тех — шестьэлектронов. |
| | | | |
| - | <br>В зависимости от энергии электронные облака, или орбитали. отличаются размерами. Понятно, что чем меньше запас энергии электрона, тем сильнее притягивается он к ядру и тем меньше по размерам его орбиталь. | + | <br>1. Электроны в атомах химических элементов располагаются на энергетическнх уровнях. 2. На первом энергетическом уровне могут находиться только два электрона, ва втором — восемь. Такие уровни называются завершенными. 3. Число уровней равно номеру периода, в котором находится химический элемент. 4. Число электронов на внешнем уровне атома химического элемента равно номеру eгo группы (для элементов главных подгрупп). 5. Свойства химических элементов периодически повторяются, так как периодически повторяется строение внешних энергетических уровней у их атомов.<br> <br>Изобразите схемы строения атомов следующих химических элементов: а) алюминия; б) фосфора; в) кислорода.<br>Сравните строение атомов: а) азота и фосфора; б) фосфора и серы. |
| | | | |
| - | <br>Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона или электронным облаком.<br> | + | <br>В следующих предложениях вставьте пропущенные слова: Атом кремния содержит в ядре ... протонов и ... нейтронов- Число электронов, находящихся вокруг ядра, как и число протонов, равно ... элемента. Число энергетических уровней определяется номером ... и равно .... Число внешних электронов определяется номером ... В равно...». |
| | | | |
| - | Мы можем изобразить строение атомов более полными электронными формулами.<br>Запишем электронные формулы атомов I и II периодов:<br> [[Image:him8-28.jpg]]
| + | <br>Почему в нервом периоде системы Д. И. Менделеева содержится только два элемента, а во втором — только восемь? |
| | | | |
| - | <br>Если элементы имеют одинаково устроевные внешние энергетические уровни, то свойстве этих элементов подобны. Ска жем. аргон н неон содержат на ввешвем уровне по восемт электронов, н потому овн инертны, то есть почти не вступаю) в химические реакции. В свободном виде аргон н неон — газы, которые имеют одноитомные молекулы.
| + | <br>Приведите примеры периодически повторяющихся явлений, с которыми вы познакомились при изучении других учебных предметов.<br>Попробуйте дать собственное толкование следующим строкам из стихотворения В. [[В._Я._Брюсов._Биография._Творчество|Брюсова]] «Мир электрона» : |
| - | | + | |
| - | <br>Атомы литии, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу Периодической системы.
| + | |
| - | | + | |
| - | <br>Сделаем обобщение; одинаковое строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяют и свойства химических элементов. Эта закономерность отражева в названии Периоды ческой смеявв химических элементов Д. И. Менделеева.<br> <br>Орбитали могут иметь разную форму. Так, каждый новый энергетический уровень в атоме начиняется с а орбитали, которая имеет сферическую форму. На каждой орбитали может находиться только два электрона. Таких орбиталей три. Любую орбиталь занимают не более двух электронов. Следовательно, на орбитали их может быть только два, а на трех сорбита тех — шестьэлектронов.
| + | |
| - | | + | |
| - | <br>1. Электроны в атомах химических элементов располагаются на энергетическнх уровнях. 2. На первом энергетическом уровне могут находиться только два электрона, ва втором — восемь. Такие уровни называются завершенными. 3. Число уровней равно номеру периода, в котором находится химический элемент. 4. Число электронов на внешнем уровне атома химического элемента равно номеру eгo группы (для элементов главных подгрупп). 5. Свойства химических элементов периодически повторяются, так как периодически повторяется строение внешних энергетических уровней у их атомов.<br> <br>Изобразите схемы строения атомов следующих химических элементов: а) алюминия; б) фосфора; в) кислорода.<br>Сравните строение атомов: а) азота и фосфора; б) фосфора и серы.
| + | |
| - | | + | |
| - | <br>В следующих предложениях вставьте пропущенные слова: Атом кремния содержит в ядре ... протонов и ... нейтронов- Число электронов, находящихся вокруг ядра, как и число протонов, равно ... элемента. Число энергетических уровней определяется номером ... и равно .... Число внешних электронов определяется номером ... В равно...».
| + | |
| - | | + | |
| - | <br>Почему в нервом периоде системы Д. И. Менделеева содержится только два элемента, а во втором — только восемь?
| + | |
| - | | + | |
| - | <br>Приведите примеры периодически повторяющихся явлений, с которыми вы познакомились при изучении других учебных предметов.<br>Попробуйте дать собственное толкование следующим строкам из стихотворения В. Брюсова «Мир электрона» : | + | |
| | | | |
| | <br>Быть может, эти электроны — | | <br>Быть может, эти электроны — |
| Строка 99: |
Строка 97: |
| | Там все, что здесь, в объеме сжатом, | | Там все, что здесь, в объеме сжатом, |
| | | | |
| - | Но также то, чего здесь нет. | + | Но также то, чего здесь нет. |
| | | | |
| - | <br>О каком поэтическом даре говорят приведенные выше строчки, если учесть, что стихотворение было написано в 1922 г.? | + | <br>О каком поэтическом даре говорят приведенные выше строчки, если учесть, что стихотворение было написано в 1922 г.? |
| | | | |
| - | <br> <sub>задания [[Химия_8_класс|для 8 класса]], вспомогательный [[Гипермаркет_знаний_-_первый_в_мире!|материал для школьников]], аудио для уроков [[Химия|химии]]</sub> | + | <br> <sub>задания [[Химия 8 класс|для 8 класса]], вспомогательный [[Гипермаркет знаний - первый в мире!|материал для школьников]], аудио для уроков [[Химия|химии]]</sub> |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Текущая версия на 12:39, 27 июня 2012
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Строение электронных оболочек атомов
Мы выяснили, что сердце атома — это его ядро. Вокруг него располагаются электроны. Они не могут быть неподвижны, так как немедленно упали бы на ядро.
В начале XX в. была принята планетарная модель строения атома, согласно которой вокруг очень малого по размерам положительного ядра движутся электроны, подобно планетам вокруг Солнца. Дальнейшие исследования показали, что строение атома значительно сложнее. Проблема строения атома остается актуальной и для современной науки.
Элементарные частицы, ядро атома, атом, молекула — все это объекты микромира, не наблюдаемого нами. В нем действуют иные законы, чем в макромире, объекты которого мы можем наблюдать или непосредственно, или с помощью приборов (микроскоп, телесной и т.д.). Поэтому, обсуждая далее строение электронных оболочек атомов, будем понимать, что мы создаем свое представление (модель), которое в значительной степени соответствует современным взглядам, хотя и не является абсолютно таким же, как у ученого-химика. Наша модель упрощена.
Электроны, двигаясь вокруг ядра атома, образуют в совокупности его злектронную оболочку. Число электронов в оболочке атома равно, как вы уже знаете, числу протонов в ядре атома и определяется порядковым или атомным номером элемента в таблице Д. И. Менделеева. Так, электронная оболочка атома водорода состоит из одного электрона, хлора — из семнадцати, золота - из семидесяти девяти. Как же движутся электроны? Хаотически, подобно мошкам вокруг горящей лампочки?
Или же в каком-то определенном порядке? Оказывается, именно в определенном порядке.
Электроны а атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие — слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним, и их труднее вырвать из электронной оболочки, а вот чем дальше они от ядер, тем легче их оторвать. Очевидно, что по мере удаления от ядра атома запас энергии электрона увеличивается.
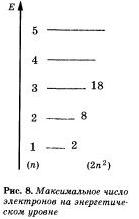
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются здектронные слои в электронной оболочке атома. Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями. Мы далее так и будем говорить: Электрон находится на определенном энергетическом уровне.
Число энергетических уровней равно номеру периода в таблице Д. И. Менделеева, в котором находится химический элемент. Значит, электронная оболочка атомов первого периода содержит один энергетический уровень, второго период — два, третьего — три и т. д. Например, в атоме азота оно состоит из двух энергетических уровней, а в атоме магния - из трех:
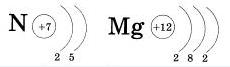
В курсе химии 8 — 9 классов мы будем рассматривать елементи только первых трех периодов, поэтому с завершенным третьим энергетическим уровнем у атомов мы не встретимся.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Теперь мы можем составить схемы строении электронных оболочек атомов, руководствуясь следующим планом:
а) определим общее число электронов на оболочке по порядковому номеру элемента;
б) определим число энергетических уровней в электронной оболочке по номеру периода;
в) определим число электронов на каждом энергетическом уровне (на 1 -м — не больше двух; на 2-м — не более восьми, на
внешнем уровне число электронов равно номеру группы — для элементов главных подгрупп).
Ядро атома водорода имеет заряд (+1). то есть содержит только олив протон, соответственно только один алектров на единственном энергетическом уровне. Схематично это представлено ниже, записывается с помощью электронной формулы следующим образом:
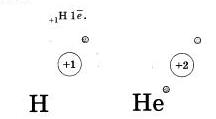
Следующий элемент I периода гелий. Ядро атома гелия имеет заряд (+2). V него ва энергетическом уровне имеются уже два электрона:
На первом энергетическом уровне могут поместиться только два электрона и никак ве больше — он полностью завершен. Потому-то I период системы Менделеева и состоит из двух элементов.

У атома лития, элемента II периода, появляется еще один энергетический уровень, на который отправится третий электрон:

У атома бериллия на второй уровень попадает, еще одни электрон:
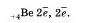
Атом бора на внешнем уровне имеет три электрона, а атом углерода — четыре электрона; атом фтора — семь электронов, атом неона — восемь электронов.
Второй уровень может вместить только восемь электронов, в поэтому ов завершен у неона.
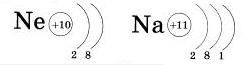
У атома натрия, элемента III периода, появляется третий энергетический уровень (обратите внимание — атом элемента III периода содержит три энергетических уровни)), и на нем находится один электрон.
Будем внимательными: натрий — элемент 1 группы, на внешнем энергетическом уровне у него один электрон.
Очевидно, нетрудно будет записать строение энергетических уровней для атома серы, элемента VI группы III периода.
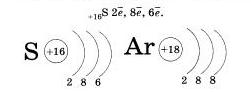
Атомы элементов IV периода конечно же имеют четвертый уровеннь.
Начнем с аналогии. Подобно тому как быстро движущаяся игла швейной машинки, пронзая ткань, вышивает на ней узор, так и неизмеримо быстрее движущийся в пространстве вокруг атомного ядра электрон вышивает, только не плоский, а объемный рисунок электронного облика — орбитали. Таи как скорость движения электрона в сотни тысяч раз больше скорости движения швейной иглы, то говорят о вероятности нахождения электрона в том или миом месте пространства. Допустим, что вам удалось, как на спортивном фотофинише, установить положение электрона в каком-то месте около ядра и отметить это положение точкой. Если такой фотофиниш сделать сотни, тысячи ряд, то получится модель электронного облака.
В зависимости от энергии электронные облака, или орбитали. отличаются размерами. Понятно, что чем меньше запас энергии электрона, тем сильнее притягивается он к ядру и тем меньше по размерам его орбиталь.
Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона или электронным облаком.
Мы можем изобразить строение атомов более полными электронными формулами.
Запишем электронные формулы атомов I и II периодов:
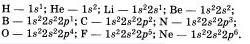
Если элементы имеют одинаково устроевные внешние энергетические уровни, то свойстве этих элементов подобны. Ска жем. аргон н неон содержат на ввешвем уровне по восемт электронов, н потому овн инертны, то есть почти не вступаю) в химические реакции. В свободном виде аргон н неон — газы, которые имеют одноитомные молекулы.
Атомы литии, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу Периодической системы.
Сделаем обобщение; одинаковое строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяют и свойства химических элементов. Эта закономерность отражева в названии Периоды ческой смеявв химических элементов Д. И. Менделеева.
Орбитали могут иметь разную форму. Так, каждый новый энергетический уровень в атоме начиняется с а орбитали, которая имеет сферическую форму. На каждой орбитали может находиться только два электрона. Таких орбиталей три. Любую орбиталь занимают не более двух электронов. Следовательно, на орбитали их может быть только два, а на трех сорбита тех — шестьэлектронов.
1. Электроны в атомах химических элементов располагаются на энергетическнх уровнях. 2. На первом энергетическом уровне могут находиться только два электрона, ва втором — восемь. Такие уровни называются завершенными. 3. Число уровней равно номеру периода, в котором находится химический элемент. 4. Число электронов на внешнем уровне атома химического элемента равно номеру eгo группы (для элементов главных подгрупп). 5. Свойства химических элементов периодически повторяются, так как периодически повторяется строение внешних энергетических уровней у их атомов.
Изобразите схемы строения атомов следующих химических элементов: а) алюминия; б) фосфора; в) кислорода.
Сравните строение атомов: а) азота и фосфора; б) фосфора и серы.
В следующих предложениях вставьте пропущенные слова: Атом кремния содержит в ядре ... протонов и ... нейтронов- Число электронов, находящихся вокруг ядра, как и число протонов, равно ... элемента. Число энергетических уровней определяется номером ... и равно .... Число внешних электронов определяется номером ... В равно...».
Почему в нервом периоде системы Д. И. Менделеева содержится только два элемента, а во втором — только восемь?
Приведите примеры периодически повторяющихся явлений, с которыми вы познакомились при изучении других учебных предметов.
Попробуйте дать собственное толкование следующим строкам из стихотворения В. Брюсова «Мир электрона» :
Быть может, эти электроны —
Миры, где пять материков.
Искусства, званья, воины, троны
И тпамять сорока веков.
Еще, быть может, каждый атом —
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
О каком поэтическом даре говорят приведенные выше строчки, если учесть, что стихотворение было написано в 1922 г.?
задания для 8 класса, вспомогательный материал для школьников, аудио для уроков химии
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|