|
Гіпермаркет Знань>>Біологія>>Біологія 10 клас>> Біологія: Білки – складні біополімери. Будова і властивості білків.
Пригадайте Що таке макромолекули, мономери і полімери? Яка роль білків у житті організмів? Що таке гемоглобін і ферменти?
Ці сполуки переважають у клітинах і кількісно. Так, у клітинах тварин вони становлять до 40-50% сухої речовини, а рослин - до 20-35%. До складу молекул білків входять атоми Карбону, Оксигену, Нітрогену, Гідрогену, Сульфуру, а також Фосфору, Феруму та ін.
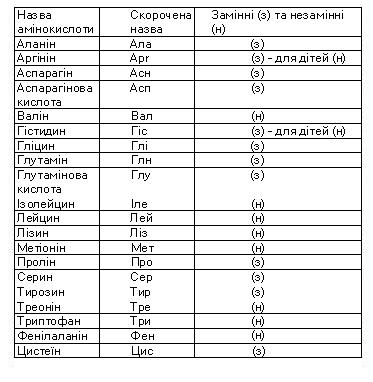
Що собою становлять білки? Білки - це висо-комолекулярні біополімери, мономерами яких є залишки амінокислот (мал.8). Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків лише 20 амінокислот (кількість можливих варіантів у цьому випадку становить приблизно 2 • 1018). Кожен білок характеризується постійним складом амінокислотних залишків та їхньою певною послідовністю. Усі амінокислоти мають спільну групу атомів. Вона складається з аміногрупи (-NH2), якій притаманні лужні властивості, та карбоксильної групи (—СООН) з кислотними властивостями. Ці групи, як і атом Гідрогену, зв'язані з одним і тим самим атомом Карбону. Групи атомів, за якими амінокислоти розрізняються між собою, називають радикалами, або R-групами. Двадцять амінокислот, залишки яких входять до складу білків, називають основними. Існують різні класифікації амінокислот. Зокрема, їх поділяють на замінні та незамінні. Замінні амінокислоти можуть синтезуватись в організмі людини і тварин з продуктів обміну речовин. Натомість незамінні амінокислоти в організмі людини і тварин не синтезуються. Вони надходять разом з їжею. їх синтезують рослини, гриби, бактерії. Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять ті чи інші незамінні амінокислоти. У таблиці наведено повні та скорочені назви амінокислот.
Яка будова білків? Амінокислотні залишки у молекулі білка сполучаються між собою міцним ковалентним зв'язком, який виникає між карбоксильною групою однієї амінокислоти і аміногрупою іншої.
...NH2—CH—CO—NH—CH—CO—NH—CH—COOH...
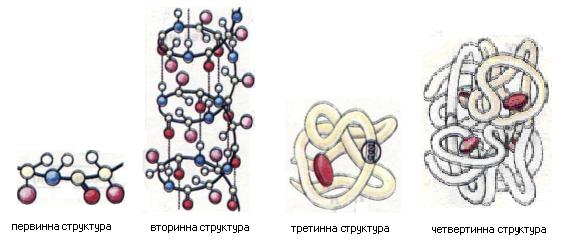
Поліпептиди з високою молекулярною масою (понад 6000) називають білками. Вони складаються з одного або кількох поліпептидних ланцюгів, які можуть містити до кількох тисяч амінокислотних залишків. Відомо чотири рівні структурної організації білків: первинний, вторинний, третинний і четвертинний (мал.9). Часто молекула білка у вигляді ланцюга, складеного з амінокислотних залишків, нездатна виконувати специфічні функції. Для цього вона має набути складнішої просторової структури.
Схема пептидного зв 'язку Мал. 9. Просторові моделі структурної організації білків
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватись певним чином у грудку, або глобулу (від лат. глобулюс - кулька). На малюнку 9 наведено схематичну структуру білка міоглобіну. Важлива роль у підтриманні третинної структури належить так званим дисульфідним зв'язкам, які виникають між залишками амінокислоти цистеїну. Четвертинна структура білків виникає внаслідок об'єднання окремих глобул, які разом утворюють функціональну одиницю. На малюнку 9 схематично зображено четвертинну структуру гемоглобіну, молекула якого складається з чотирьох фрагментів білка міоглобіну. Стабілізація четвертинної структури досягається гідрофобними, електростатичними та іншими взаємодіями, а також водневими зв'язками. Залежно від конфігурації білки можуть бути фібрилярними та глобулярними. Молекули фібрилярних білків складаються з видовжених, паралельно розташованих поліпептидних ланцюгів. Як правило, ці білки нерозчинні у воді й виконують в організмі структурну функцію (наприклад, кератин входить до складу волосся людини або шерсті тварин). Молекули глобулярних білків складаються зі щільно скручених поліпептидних ланцюгів і за формою нагадують кульку. Ці білки здебільшого розчинні у воді та сольових розчинах. Вони виконують в організмі різноманітні функції (наприклад, гемоглобін забезпечує транспорт газів, пепсин - розщеплення білків їжі). Залежно від особливостей будови білки поділяють на прості та складні. Прості, або протеїни (від грец. протос — перший), складаються лише з амінокислотних залишків, а складні, або протеїди (від грец. протос та ейдос - вигляд), у своєму складі мають також залишки фосфатної та нуклеїнових кислот, вуглеводів, ліпідів, атоми Феруму, Цинку, Купруму та ін.
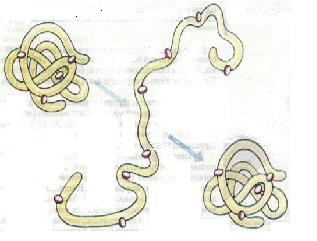
Які властивості білків? функціональні властивості білків, крім їхнього амінокислотного складу, зумовлені також і послідовністю амінокислотних залишків у поліпептидному ланцюзі та його просторовою структурою. Одна з основних властивостей білків — це їхня здатність під впливом різних факторів (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням поліпеп-тидного ланцюга без зміни його первинної структури, називають денатурацією (від лат. де - префікс, який означає втрату, і натура - природні властивості) (мал. 10). Як правило, денатурація має необоротний характер. Проте на початкових стадіях денатурації за умови припинення дії факторів, що спричиняють цей процес, білок може відновити свій початковий стан. Це явище має назву ренатурації (від лат. ре -префікс, який означає поновлення). У живих організмів відбувається часткова оборотна денатурація білків, пов'язана з виконанням ними певних функцій - забезпеченням рухової активності, передачею в клітини сигналів з довкілля, прискорення біохімічних реакцій тощо. Процес порушення первинної структури білків називають деструкцією (від лат. деструкціо - руйнування). Він завжди має необоротний характер. Залежно від розчинності або нерозчинності у воді білки поділяють на гідрофільні та гідрофобні. Серед білків є активні у хімічному відношенні (наприклад, ферменти) і малоактивні. Деякі білки стійкі до дії різних факторів (наприклад, температури, хімічних чинників), інші - нестійкі. Наприклад, кератин, який входить до складу волосся, кігтів, нігтів, копит, здатний витримувати високу й низьку температуру. Натомість білок яйця птахів (овальбумін) при нагріванні змінює свою структуру.
1. Що таке білки? Що спільного та відмінного в процесах денатурації та деструкції?
М.Є. Кучеренко, Ю.Г. Первес, П.Г. Балан, В.М. Войціцький, Загальна біологія, 10 клас
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: