|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Фізичні властивості оксидів. Класифiкація оксидів. Оксиди в природі. Використання оксидів. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміниОксиди (або оксили) - складні речовини, до яких входять два елементи, один з яких Оксиген зі ступенем окиснення -2. Основні оксиди – оксиди металів, гідрати яких є основами. Кислотні оксиди (ангідриди кислот) – оксиди, гідратами яких є кислоти. Амфотерні оксиди – оксиди, яким відповідають амфотерні гідроксиди, здатні в залежності від умов реакції виявляти властивості як кислотних, так і основних кислот. Хід урокуФізичні властивості оксидівОксиди (або оксили) - це складні речовини, до яких входять два елементи, один з яких Оксиген зі ступенем окиснення -2. Для кращого розуміння сутності оксидів, пропонуємо переглянути наступне відео. Відео 1. Оксиди.
Виділяють декілька основних фізичних властивостей оксидів: 1) Всі основні й амфотерні оксиди не мають запаху; Мал. 1. Оксид цинку. b. CuO – чорний; Мал. 2. Оксид купруму. c. Cr2O3 – зелений; Мал. 3. Оксид хрому. d. Al2O3 - червоний або синій (рубін і сапфір) і ін. Мал. 4. Оксид алюмінію. 3) Окремі кислотні оксиди є твердими (P2O5, SiO2 і ін.); 4) Виділяють декілька газоподібних кислотних оксидів (CO2, SO2 і ін.) Контролюючий блок 1
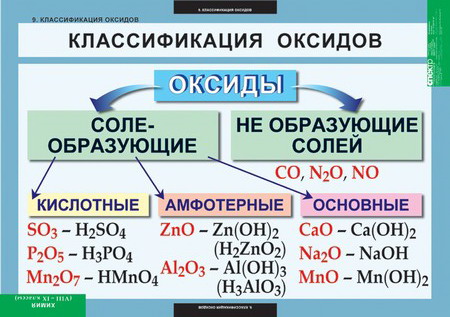
Класифікація оксидівПрактично всі хімічні елементи утворюють оксиди, окрім благородних нагів: гелію, неону та аргону. За хімічними властивостями оксиди поділяються на три групи: основні, кислотні й амфотерні. Мал. 5. Класифікація оксидів. Основними називаються такі оксиди, яким відповідають основи. Наприклад, Основні оксиди утворюються тільки металами. Деякі основні оксиди взаємодіють з водою і утворюють основи: Для інших основних оксидів відповідні основи утворюються із солей: Кислотними оксидами називаються такі оксиди, яким відповідають кислоти. Наприклад: Більшість кислотних оксидів утворюють кислоти під час взаємодії з водою: Кислотні оксиди утворюються неметалами і деякими металами, що виявляють вищі ступені окиснення (наприклад, хром (VI) оксиду CrO3 відповідає хроматна кислота H2CrO4). Амфотерними називаються такі оксиди, які залежно від умов виявляють основні або кислотні властивості, тобто мають подвійні властивості. Користуючись періодичною системою Д.І. Менделєєва перехід від основних оксидів через амфотерні до кислотних закономірно змінюється від ІІ до VI періодів. Так властивості оксидів елементів ІІІ періоду закономірно змінюються від основних (Na2O, MgO) через амфотерні Al2O3 до кислотних (SiO2, P2O5 SO3 Cl2O7). Основні, кислотні й амфотерні оксиди є солетворними, тобто здатні утворювати солі під час взаємодії з кислотами або основами. Оксиди, які не виявляють ані кислотних, ані основних властивостей і не утворюють солей, називаються байдужими, або індиферентними. До них належать карбон (ІІ) оксид СО, нітроген (І) оксид N2O, нітроген (ІІ) NO і силіцій (ІІ) оксид SiO. Можете спостерігати процес відновлення оксиду на наступному відео. Відео 2. Відновлення оксиду міді воднем.
Контролюючий блок 2
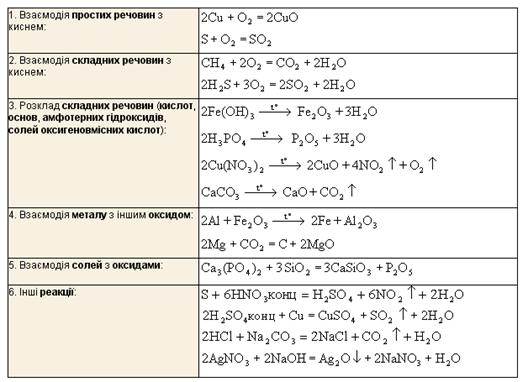
Оксиди в природі та їх використанняОксиди елементів утворюються внаслідок нагрівання простих речовин при наявності кисню або повітря; при розкладанні основ, кислот, амфотерних гідроксидів, солей кисневмісних кислот; при випалюванні сульфідів, фосфідів, спалюванні горючих водневих сполук; при взаємодії кислот-окислювачів з металами та неметалами, солей деяких металів з лугами, кислотами, оксидами тощо. Наводимо приклади реакцій, за якими можна добути відповідний оксид: Мал. 6. Добування оксидів. У природі оксиди взаємодіють з різноманітними речовинами. Процес взаємодії оксиду з киснем ви можете спостерігати на наступному відео. Відео 3. Оксид сірки і кисень.
Контролюючий блок 3
Домашнє завданняДайте повну характеристику оксидам (Cr2O3, MgO, TiO2, CO2) за наступними пунктами: коротка характеристика кожного хімічного елемента (назва, валентність, група); приналежність його до певних видів оксидів (амфотерні, основні, кислотні / солетворні, несолетворні); в яких реакціях можуть брати участь, з якими сполуками взаємодіяти. Цікаво знати, що…Описуючи властивості карбон (IV) оксиду, нерідко вказують, що Вуглекислий газ не підтримує горіння. Чи це завжди так? Ні, не завжди. Деякі речовини, запалені на повітрі, продовжують горіти і в атмосфері вуглекислого газу. Це можна показати на такій спробі. Наповніть вуглекислим газом великий циліндр або колбу місткістю біля літра і внесіть у нього запалену на повітрі магнійову стрічку. Магній продовжує горіти і у вуглекислому газі, щоправда, не так яскраво. У посуді, де горить магній, з’являється білий дим та кіптява. Як пояснити це явище? Магній більше споріднений з киснем, ніж вуглець. При високій температурі магній руйнує молекулу вуглекислого газу, сполучаюсь з киснем: 4Mg + CO2 = 2MgC + 2MgO. Витратою енергією на руйнування молекули вуглекислого газу пояснюється тьмяне горіння магнію. Кіптява являє собою звільнений вуглець. Отже, деякі речовини можуть горіти і в вуглекислому газі. Звичайно, вуглекислий газ не підтримує горіння вуглецевих сполук. Список використаних джерел1. Урок на тему «Оксиди та їх місце у нашому житті» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Кузнєцова О.М. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: