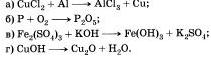|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Химические уравнения
Закон сохранения массы веществ, открытый М. В. Ломоносовым в 1756 г., гласит:
Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате ее.
Материальными носителями массы веществ являются атомы химических элементов, из которых состоят как вступившие в реакцию вещества (реагенты), так и образовавшиеся в результате ее новые вещества (продукты реакции). Поскольку при химических реакциях атомы не образуются н не разрушаются, а происходит лишь их перегруппировка, то становится очевидным справедливость открытого М. В. Ломоносовым и подтвержденного позднее А. Лавуазье закона.
В справедливости закона сохранения массы веществ можно легко убедиться на простом опыте. Поместим в колбу немного красного фосфора, закроем ее пробкой и взвесим на весах. Затем колбу, осторожно нагреем.
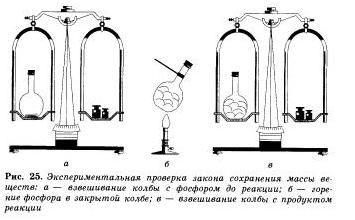
О том, что произошла химическая реакция, нам станет понятно по появлению густого белого дыма в колбе, состоящего из оксида фосфора (V). который образовался при взаимодействии фосфора с кислородом. При повторном взвешивании колбы с продуктами этой реакции мы убедимся, что масса веществ в колбе не изменилась, хотя и произошло превращение фосфора в его оксид.
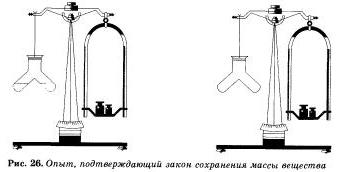
Этот же вывод будет нами сделан и при проведении еще одного простого, но очень наглядного опыта. В специальный сосуд нальем отдельно соляную кислоту и раствор щелочи, например гидрокспда натрия. К раствору щелочи добавим несколько капель индикатора — фенолфталеина, отчего раствор окрасится в малиновый цвет. Закроем прибор пробкой, уравновесим гирями на весах, отметим массу, а затем сольем растворы. Малиновая окраска исчезнет, потому что кислота и щелочь прореагировал и друг с другом. Масса же сосуда с полученными продуктами реакции не изменилась.
Аналогичное наблюдение сделал и автор закона М. В. Ломоносов, который проводил опыты в запаянных стеклянных сосудах, «дабы исследовать, прибывает ли вес металла от чистого жару», и обнаружил, что «без пропущения внешнего воздуха вес металлов остается в одной мере».
На основании этого закона пишутся химические предложения, то есть составляются уравнения химических реакций с помощью химических слов — формул.
Химические уравнением называется условная запись химической реакции с помощью химических формул и математических знаков.
В левой чести уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяют их знаком плюс. В правой части уравнения записывают формулы (формулу) образующихся веществ, также соединенных знаком плюс. Между частями уравнения ставят стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения были равны.
Запишем, например, следующее уравнение реакции:
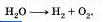
Так как число атомов кислорода в первой части вдвое больше, чем в левой, запишем перед формулой воды коэффициент 2:
2Н2О —> Н2 + О2
Но теперь в левой частя уравнения стало четыре атома водорода, а в правой их осталось два. Чтобы уравнять число атомов водорода, запишем перед его формулой в правой части также коэффициент 2. Так как мы уравняли число атомов каждого элемента в левой и правой частях уравнения, заменим стрелку на знак равенства:
2H2O = 2Н2 + О2
Теперь, наверное, вам понятно, почему такая запись называется уравнением.
С помощью уравнений химических реакций можно определить и тип реакции. Так, рассмотренная выше реакция относится к реакция я разложения, то есть таким, при которых ил одного сложного вещества образуются два и более новых простых или сложных вещества, но более простого состава.
При разложении, например, гидроксида железа (III) образуются оксид железа (III) и вода:
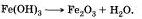
Химические реакции противоположного типа называются реакциями соединения. В реакции соединения вступают одно или несколько простых или сложных веществ, из которых образуется одно более сложное вещество.
Например, водород и кислород при горении, соединяясь, образуют воду:
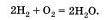
К реакциям соединения относится и рассмотренная ранее нами реакция получения сульфида железа (II) из порошков серы и железа. Интересно отметить, что реакции соединения и реакции разложения сопровождаются противоположными тепловыми эффектами: реакции соединения чаще относятся к экзотермическим, а реакции разложения — к эндотермическим.
Если в раствор сульфата меди (ІІ) опустить железную скрепку, то очень скоро она покраснеет из-за выделившейся на ней меди, а в раствор перейдет сульфат железа (II):
CuSO4+Fe= FeSO4 + Cu
Мы записали уравнение реакции замещения, то есть такой реакции, при осуществлении которой атомы простого вещества замещают атомы одного нэ элементов а сложном веществе.
В результате этой реакции образуются два новых вещества — простое и сложное.
К реакция обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Например, к раствору медного купороса сульфата меди (II) прильем несколько капель раствора едкою натра — гидроксида натрия, выпадает голубой осадок гидроксида меди (II). При этом образуется еще одно сложное вещество — растворимая соль сульфат натрия:
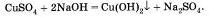
Если к полученному осадку прилить раствор серной кислоты, то мы заметим растворение полученного осадка в результате другой реакции обмена:
Cu(OH)2 + H2SO4 = CuSO4 + 2HOH
Следовательно, уравнение химической реакции показывает, какие вещества вступают во взаимодействие и какие вещества при этом образуются, в каких количественных отношениях они находятся и какого типа эта реакция.
Например, уравнение
4Al + 3O2 = 2Al2O3
показывает, что в результате реакции соединения четыре моля алюминия взаимодействуют с тремя молями кислорода и образуют при этом два моля оксида алюминия.
1. Химические уравнения.
2. Реакции разложения.
3. Реакции соединения.
4. Реакции замещения.
5. Реакции обмена.
Запишите в виде химических уравнений следующие предложения: а) При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)
б) При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота. Каков тип указанных реакций? Какая из них будет экзо-, а какая эндотермической?
Составьте уравнения по следующим схемам и укажите тип реакции:
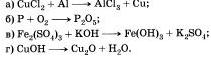
Под формулами веществ напишите их названия. Запишите уравнения химических реакций по следующим схемам:
а) фосфорная кислота + гидроксид натрия —> фосфат натрия + вода;
б) оксид натрия + вода —> гидроксид натрия;
в) оксид железа (II) + алюминий —> оксид алюминий + железо;
г) гидроксид меди (II) —> оксид меди (II) + вода.
Укажите тип реакции.
Что показывает уравнение следующей химической реакции:
Какое количество водорода взаимодействует с 1 моль оксида железа (III)? Какой обьем водорода взаимодействует с 1 моль оксида железа (III)? Какое количество железа при этом образуется? Сколько молекул воды при этом получается?
таблицы к уроку химии 8 класса, схемы и графики к урокам химии, пособия и учебники по всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|