|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Реакція нейтралізації. Заходи безпеки під час роботи з лугами. Використання лугів. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
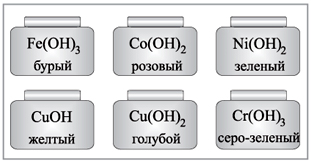
Хід урокуХімічні властивості лугів, взаємодія їх з різними неорганічними сполукамиУсі основи – тверді речовини. За розчинністю у воді їх поділяють на розчинні – луги – і нерозчинні. Луги милкі на дотик, вони являють собою йонні сполуки. Нерозчинні основи – йонно-ковалентні сполуки. Мал.1 . Фізичні властивості лугів. Хімічні властивості лугів: 1.Водних розчинах майже повністю дисоціюють на йони: KOH = K + OH Ca(OH)2 = Ca + 2OH 2. Змінюють забарвлення індикаторів: лакмус – синіє, фенолфталеїн стає малиновим, метиловий оранжевий - жовтим, універсальний індикаторний папір змінює колір на відтінки від зеленого до синьо-фіолетового. Мал 2. Забарвлення деяких лугів. Те, як діють луги на окремі індикатори ви можете спостерігати на наступному відео. Відео 1. Дія лугів на індикатори.
3. Взаємодіють із слабкими і сильними кислотами, утворюючи солі і воду, - реакція нейтралізації: NaOH + HNO3 = NaNO3 + H2O 2NaOH + H2SiO3 = Na2SiO3 + 2H2O Взаємодію лугів з кислотами можна спостерігати на наступному відео. Відео 2. Взаємодія розчину лугів з оцтовою кислотою.
4. Взаємодіють з кислотними оксидами, утворюючи солі і воду: 2NaOH + O3 = Na2SO4 + H2O 5. Взаємодіють з амфотерними гідроксидами: - у водних розчинах утворюються комплексні сполуки (залежно від співвідношення між кількостями речовин реагентів): 3NaOH + Al(OH)3 = Na3[Al(OH)6] – натрій гексагідроксоалюмінат NaOH + Al(OH)3 = Na[Al(OH)4] – натрій тетрагідроксоалюмінат - у розплавах утворюються безводні солі: NaOH + Al(OH)3 = NaAlO2 + 2H2O – натрій метаалюмінат 3NaOH + Al(OH)3 = Na3AlO3 + 3H2O – натрій ортоалюмінат 6. Взаємодіють з амфотерними оксидами, утворюючи сіл і воду (тільки під час стоплення): 2NaOH + ZnO = Na2ZnO2 + H2O – натрій цинкат 2NaOH + Cr2O3 = NaCrO2 + H2O – натрій мета хроміт 7. Взаємодіють з солями у водних розчинах. Реакція необоротна, якщо хоча б один з утворених речовин випадає в осад: 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl Ba(OH)2 + K2SO4 = BaSO4 + 2KOH Контролюючий блок 1
Заходи безпеки під час роботи з лугамиЛуги мають зберігатися у витяжній шафі, суліях, упакованих у спеціальні кошики з деревною стружкою. Ні в якому разі не зберігайте сулії незахищеними від можливого удару, а також їх відкритими в кімнаті, не можна переміщувати сулії за відсутності решетування, або самому. Не можна переміщувати їх на грудях, спині, плечах. Мал. 4. Сулія. 3. Для розливу сулію необхідно поставити в спеціальний штатив i, обережно нахиляючи її, повільно наливати луг через лійку. 4. При роботі з лугами треба одягати гумові рукавички, клейончасті або поліетиленові нарукавники i фартух. 5. На лугах має бути напис з вказівкою виду лугу, його концентрації i додатковий напис "Звертатися обережно". 6. При проведенні аналізів луги варто відмірювати піпеткою, на вільний кінець якої попередньо надітий гумовий балончик або гумова трубка; у верхній частині піпетки повинний бути вставлений "заслін" з тонкого шару вати. 7. Місце, уражене лугом, промити великою кількістю води, а потім 2-х процентним розчином оцтової кислоти. При серйозному ушкодженні слизуватої оболонки рота докласти вчителю i негайно звернутися до лікаря. Контролюючий блок 2
Використання та добування лугівВирізняють різноманітні способи добування лугів. Основними з них є наступні: 1. Взаємодія лужних і лужноземельних металів з водою: 2Na + 2H2O = 2NaOH + H2 Ca + 2H2O = Ca(OH)2 + H2 Реакцію взаємодії лужних металів з водою ви можете спостерігати на запропонованому нижче відео. Відео 3. Взаємодія лужних металів з водою.
2. Взаємодія оксидів лужних і лужноземельних металів з водою: Na2O + H2O = 2NaOH BaO + H2O = Ba(OH)2 3. Взаємодія солей з лугами, якщо в результаті реакції утворюються нерозчинні солі: K2CO3 + Ca(OH)2 = CaCO3 + 2KOH Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH 4. Електроліз водних розчинів. Якщо через водний розчин натрій хлориду пропустити постійний електричний струм, то на катоді виділяється водень, на аноді – хлор, а в розчині накопичується натрій гідроксид: NaCl = Na + Cl H2O = H + OH На катоді: 2H = H2 На аноді: 2Cl = Cl2 У розчині в катодному просторі залишається натрій гідроксид. Контролюючий блок 3
Домашнє завданняЯкі луги, як ви знаєте, найчастіше зустрічаються у припроді? Для чого вони використовуються? Цікаво знати, що…Робити справжні феєрверки складно і небезпечно. Але ви можете зробити безпечні кольорові вогні і запалити їх під час свята з друзями. У невеликих кількостях їх можна запалювати не тільки на вулиці, але і в приміщенні. Для приготування вогнів вам знадобиться сухий спирт, азотнокислий барій, азотнокислий стронцій і деякі інші речовини. Кожну речовину потрібно розтовкти окремо у фарфоровій ступці до одержання тонкого порошку. Для зеленого вогню змішайте термініт з азотнокислим барієм (у рівних кількостях). Зберігайте порошки та їх суміші в скляних банках з притертими пробками, так як вони бояться вогкості. Спалюйте суміші на металевих листах або на цеглинах. Насипте суміш гіркою діаметром 80 - 100 мм, висотою близько 20 мм і підпаліть сірником. Добре просушена суміш дає яскравий, чистий і красивий вогонь. Спробуйте зробити вогні іншого кольору. Запам'ятайте, що полум'я забарвлюється: в жовтий колір - хлористим натрієм (повареною сіллю), у ліловий - вуглекислим калієм - поташем, у синій - азотнокислої міддю. Список використаних джерел1. Урок на тему «Основи та їх основні види» Осмінкіної Л. М. СЗШ № 28, м. Астрахань.
Осмінкіна Л.М. Русецька О.П. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: