|
Гіпермаркет Знань>>Хімія>>Хімія 7 клас>> Хiмічні рівняння
На основі закону збереження маси можна складати рівняння хімічних реакцій, або хімічні рівняння.
Хімічне рівняння — це умовний запис реакції за допомогою хімічних формул і математичних знаків.
Як же скласти хімічне рівняння, припустімо, горіння водню й утворення води?
Спочатку запиши формули речовин, які реагують між собою, тобто водню Н2 і кисню О2 (у процесі горіння водень взаємодіє з киснем повітря), сполучивши їх знаком плюс. У правій частині після стрілки запиши формулу добутого продукту:
Н2 + O2 -> Н2O
Запис відображає схему реакції. Тепер підбери коефіцієнти, аби кількість атомів кожного елемента в лівій і правій частинах рівняння була однакова. Після цього стрілку можна замінити на знак «дорівнює». Дістанеш:
2Н2 + O2 = 2Н2O
Схема реакції перетворилася на рівняння реакції.
Зверни увагу, що коефіцієнт 2 перед формулою води Н2О стосується всієї формули речовини, хоча формула і не взята в дужки, як це робиться в алгебраїчних записах типу 2а + 2в = 2(а + в), але розуміти хімічний запис треба саме так: 2(Н2O).
Підбираючи коефіцієнти в рівнянні хімічної реакції, треба пам'ятати, що
сума атомів кожного елемента до реакції повинна дорівнювати сумі атомів кожного елемента після реакції.
Це положення випливає із закону збереження маси речовин. При цьому не треба думати, що, підбираючи коефіцієнти, ми довільно додаємо будь-які молекули чи атоми. Складаючи рівняння, ми лише намагаємося правильно показати співвідношення частинок речовин, які вступили в реакцію і які утворилися внаслідок реакції. Так, рівняння реакції горіння вуглецю С
C + O2 = CO2
відображує той факт, що кожен атом Карбону С взаємодіє з молекулою кисню O2, утворюючи молекулу вуглекислого газу СO2. Під час взаємодії навіть найменшого кусочка вуглецю з киснем у реакції беруть участь величезні кількості атомів Карбону і молекул кисню. Але співвідношення між числом атомів Карбону і числом молекул кисню дорівнює 1:1
КОРОТКІ ВИСНОВКИ
Під час перебігу хімічних реакцій атоми не зникають і не утворюються з нічого. їхня кількість залишається незмінною до і після реакції.
Закон збереження маси полягає в тім, що маса речовин, які вступають у реакцію, дорівнює масі утворених продуктів.
Сутність хімічної реакції полягає у перерозподілі атомів, що містилися у вихідних речовинах, і утворенні з них нових сполук.
Рівняння хімічної реакції складається на підставі закону збереження маси речовин.
Рівняння хімічної реакції, або хімічне рівняння, показує: а) які речовини беруть участь у реакції; б) які речовини утворюються; в) яке співвідношення речовин. Підбирання коефіцієнтів у рівнянні хімічної реакції ґрунтується на тому, що число атомів елементів не змінюється під час перебігу хімічної реакції, оскільки атоми зберігаються.
Завдання для самоконтролю
1. Що відбувається з речовинами під час перебігу хімічної реакції?
2. Як формулюється закон збереження маси? Ким, коли і як він був відкритий?
3. На терезах зрівноважили свічку, запалили її і побачили, що маса свічки зменшилась (мал. 59). Чому? Хіба в цьому разі не проявляється закон збереження маси речовин? Поясни другу частину малюнка.
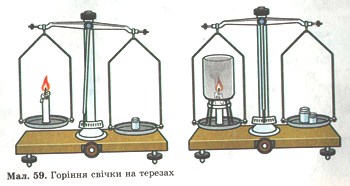
Мал. 59. Горіння свічуи на терезах.
4. Що відображує схема реакції, а що — хімічне рівняння? Яка відмінність між ними?
5, Склади рівняння реакцій за схемами:
Zn + O2 -> ZnO Mg + HCl -> MgCl2 + H2
Al + S -> Al2S3 KClO3 -> KCl + O2
Na + Cl2 -> NaCl Fe2O3 + Al -> Al2O3 + Fe
Додаткові завдання
6. У реторту з зажимом (мал. 60) помістили мідні ошурки, після чого зажим закрили й реторту прожарили (модель дослідів М. Ломоносова і Р. Бойля). Як ти думаєш, чи змінилася маса реторти: а) після прожарювання; б) після того, як відкрили зажим? Відповідь обґрунтуй.
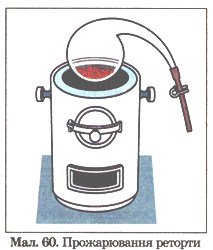
Мал. 60. 'Прожарювання реторти.
7*. На хлорування барію масою 274 г витрачено хлор Сl2 масою 142 г. Яка маса барій хлориду ВаСl2 утворилася при цьому (вважати, що втрат немає)?
8*. Під час розкладання меркурій(ІІ) оксиду HgO масою 4,34 г дістали ртуть Hg масою 4,03 г. Обчисли масу кисню O2, добутого при цьому.
9*. Склади рівняння реакцій за схемами:
ВаСl2 + AgNOз -> Ва(NO3)2 + AgCl
Аl2(SO4)3 + NаОН -> Аl(ОН)3 + Nа2SO4
Са(ОН)2 + Н3РO4 -> Са3(РO4)2 + Н2O
Аl + НСl -> АlСlз + Н2
С2Н6 + O2 -> CO2 + Н2O
10*. Користуючись періодичною системою, визнач валентність елементів, склади формули утворених продуктів і відповідні рівняння хімічних реакцій:
Mg + O2 -> Р + O2 -> Nа + S ->
Аl + Сl2 -> Н2 + Сl2 -> Аl + O2 ->
Хімія 7. Підручник для загальноосвітніх навчальних закладів. Н. М. Буринська
Планування уроків з хімії , відповіді на тести, завдання та відповіді по класам , домашнє завадання та робота з хімії 7 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













