|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Солі (середні), їх склад, назви ''' <metakeywords>Хімія, клас, урок, на Тему, Солі середні, їх склад, назви солей</metakeywords> <br><br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Солі (середні), їх склад, назви ''' <metakeywords>Хімія, клас, урок, на Тему, Солі середні, їх склад, назви солей</metakeywords> <br><br>'''Склад [[Солі,_їх_склад,_назви._Повні_уроки|солей]].''' Ти вже знаєш, що в результаті багатьох реакцій, які відбуваються з [[12._Оксиди,_їх_склад,_назви|оксидами]], [[13._Кислоти,_їх_склад,_назви|кислотами]], [[15._Основи,_їх_склад,_назви|основами]], утворюються солі.<br>Солі — це складні речовини, до складу яких входять атоми металу й кислотні залишки.<br>Складаючи формулу солі, на першому місці треба написати хімічний символ металу, поруч — кислотний залишок, тоді зазначити валентність та розставити індекси. При цьому слід керуватися таким правилом:<br>'''''сума одиниць [[Валентність_хімічних_елементів._Визначення_валентності_за_формулами_бінарних_сполук|валентності]] атомів металу має дорівнювати сумі одиниць валентності кислотних залишків.'''''<br> |
| - | | + | |
| - | <br>
| + | |
| - | | + | |
| - | <u>Тобі треба<br>мати уявлення:</u> про поширення солей у природі; <br><u>знати:</u> склад солей; фізичні властивості солей; <br><u>уміти:</u> складати формули солей і виводити їх назви.<br><br><br>'''Склад солей.''' Ти вже знаєш, що в результаті багатьох реакцій, які відбуваються з оксидами, кислотами, основами, утворюються солі.<br>Солі — це складні речовини, до складу яких входять атоми металу й кислотні залишки.<br>Складаючи формулу солі, на першому місці треба написати хімічний символ металу, поруч — кислотний залишок, тоді зазначити валентність та розставити індекси. При цьому слід керуватися таким правилом:<br>'''''сума одиниць валентності атомів металу має дорівнювати сумі одиниць валентності кислотних залишків.'''''<br>
| + | |
| | | | |
| | Приклади реакцій, унаслідок яких утворюються солі:<br>Mg + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + Н<sub>2</sub>↑<br><sup> Магній сульфат</sup> | | Приклади реакцій, унаслідок яких утворюються солі:<br>Mg + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + Н<sub>2</sub>↑<br><sup> Магній сульфат</sup> |
| Строка 11: |
Строка 7: |
| | Ca(OH)<sub>2</sub> + 2HN0<sub>3</sub> = Ca(N0<sub>3</sub>)<sub>2</sub> + 2H<sub>2</sub>0<br><sup> Кальцій нітрат</sup><br><br> | | Ca(OH)<sub>2</sub> + 2HN0<sub>3</sub> = Ca(N0<sub>3</sub>)<sub>2</sub> + 2H<sub>2</sub>0<br><sup> Кальцій нітрат</sup><br><br> |
| | | | |
| - | [[Image:Приклад реакції утворення солей.jpg]] | + | [[Image:Приклад реакції утворення солей.jpg|Приклади реакцій, унаслідок яких утворюються солі. фото]] |
| | | | |
| - | <br>Наприклад, тобі потрібно скласти формулу алюмінієвої солі сульфатної кислоти. Як треба діяти? Спершу напиши хімічний символ алюмінію Аl, поруч — кислотний залишок сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>, тобто S0<sub>4</sub>. Над знаком Алюмінію напиши валентність 3 (визнач за періодичною системою хімічних елементів). Над кислотним залишком надпиши його валентність 2 (за основністю кислоти). За допомогою індексів зрівняй сумарні валентності. Найменше спільне кратне для чисел 3 і 2 дорівнює 6. Шукаємо індекс для Алюмінію, ділячи 6 на його валентність, дістаємо 2. Так само ділимо 6<br>на валентність кислотного залишку, дістаємо 3. Звідси формула<br>Al<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>; | + | ''Мал. 5. Приклади реакцій, унаслідок яких утворюються солі.'' |
| | + | |
| | + | <br>Наприклад, тобі потрібно скласти формулу алюмінієвої солі сульфатної кислоти. Як треба діяти? Спершу напиши хімічний символ алюмінію Аl, поруч — кислотний залишок сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>, тобто S0<sub>4</sub>. Над знаком Алюмінію напиши валентність 3 (визнач за [[41._Періодичний_закон_та_періодична_система_хімічних_елементів_Д._І._Менделєєва|періодичною системою хімічних елементів]]). Над кислотним залишком надпиши його валентність 2 (за основністю кислоти). За допомогою індексів зрівняй сумарні валентності. Найменше спільне кратне для чисел 3 і 2 дорівнює 6. Шукаємо індекс для Алюмінію, ділячи 6 на його валентність, дістаємо 2. Так само ділимо 6<br>на валентність кислотного залишку, дістаємо 3. Звідси формула<br>Al<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>; |
| | | | |
| | 3-2 = 2-3. | | 3-2 = 2-3. |
| | | | |
| - | При цьому пам'ятай, хоча ми виражаємо склад солей хімічними формулами, але в кристалах солі молекул немає. Формули солей передають не склад молекул, а співвідношення атомів металу й кислотного залишку. Для алюміній сульфату Al<sub>2</sub>(S0<sub>4</sub>)3 таке співвідношення дорівнює 2 : 3. Отже, солі — речовини немолекулярної будови.<br>За формулами солей можна обчислювати значення відносної молекулярної (формульної) і молярної мас, пам'ятаючи при цьому, що реальних молекул у кристалах солей немає, вони побудовані з інших частинок — йонів. | + | При цьому пам'ятай, хоча ми виражаємо склад солей [[Хімічні_формули_речовин|хімічними формулами]], але в кристалах солі молекул немає. Формули солей передають не склад молекул, а співвідношення атомів металу й кислотного залишку. Для алюміній сульфату Al<sub>2</sub>(S0<sub>4</sub>)3 таке співвідношення дорівнює 2 : 3. Отже, солі — речовини немолекулярної будови.<br>За формулами солей можна обчислювати значення відносної молекулярної (формульної) і молярної мас, пам'ятаючи при цьому, що реальних молекул у кристалах солей немає, вони побудовані з інших частинок — йонів. |
| | | | |
| | <br> | | <br> |
| Строка 23: |
Строка 21: |
| | '''Назви солей.''' За міжнародною хімічною номенклатурою назва солі складається з назви елемента-металу й латинської назви кислотного залишку. Звичайно ж латинська назва кислотного залишку походить від латинської назви кислоти, яка, у свою чергу, походить від латинської назви елемента, що утворює кислоту. При цьому назва солі безоксигенової кислоти має суфікс -ид (-ід), а оксигеновмісної — -ат в разі максимальної валентності кис-лотоутворюючого елемента і -іт у разі його нижчої валентності. Для металів, що мають змінну валентність, у дужках після назви металу римською цифрою зазначають його валентність у даній солі (табл. 7).<br>Розглядаючи формули солей за табл. 7, ти можеш зробити висновок, що солі — це продукти заміщення атомів Гідрогену в кислоті на атоми металу. Якщо кислота двох- чи багатоосновна, то атоми Гідрогену заміщуються не всі одночасно, а послідовно. Тоді може виникнути ситуація, коли один атом Гідрогену замістився на метал, а інший — залишився. У такому разі утворюється так звана кисла сіль, на відміну від солі середньої, яка атомів Гідрогену не містить:<br>2NaOH + H<sub>2</sub>S0<sub>4</sub> = Na<sub>2</sub>S0<sub>4</sub> + 2Н<sub>2</sub>0 <br><sup>2 моль 1 моль Натрій сульфат</sup> | | '''Назви солей.''' За міжнародною хімічною номенклатурою назва солі складається з назви елемента-металу й латинської назви кислотного залишку. Звичайно ж латинська назва кислотного залишку походить від латинської назви кислоти, яка, у свою чергу, походить від латинської назви елемента, що утворює кислоту. При цьому назва солі безоксигенової кислоти має суфікс -ид (-ід), а оксигеновмісної — -ат в разі максимальної валентності кис-лотоутворюючого елемента і -іт у разі його нижчої валентності. Для металів, що мають змінну валентність, у дужках після назви металу римською цифрою зазначають його валентність у даній солі (табл. 7).<br>Розглядаючи формули солей за табл. 7, ти можеш зробити висновок, що солі — це продукти заміщення атомів Гідрогену в кислоті на атоми металу. Якщо кислота двох- чи багатоосновна, то атоми Гідрогену заміщуються не всі одночасно, а послідовно. Тоді може виникнути ситуація, коли один атом Гідрогену замістився на метал, а інший — залишився. У такому разі утворюється так звана кисла сіль, на відміну від солі середньої, яка атомів Гідрогену не містить:<br>2NaOH + H<sub>2</sub>S0<sub>4</sub> = Na<sub>2</sub>S0<sub>4</sub> + 2Н<sub>2</sub>0 <br><sup>2 моль 1 моль Натрій сульфат</sup> |
| | | | |
| - | NaOH + H<sub>2</sub>S0<sub>4</sub> = NaHS0<sub>4</sub> + Н<sub>2</sub>0<br><sup>1 моль 1 моль Натрій гідрогенсульфат</sup><br><br>Таблиця 7. Склад та назви солей<br>[[Image:Таблиця 7. Склад та назви солей.jpg]]<br><br>Як же взнати, яка сіль утвориться? Все залежить від кількості речовин, які реагують. Якщо є надлишок кислоти, то утворюється кисла сіль, якщо є надлишок лугу, — середня сіль. | + | NaOH + H<sub>2</sub>S0<sub>4</sub> = NaHS0<sub>4</sub> + Н<sub>2</sub>0<br><sup>1 моль 1 моль Натрій гідрогенсульфат</sup><br><br>''Таблиця 7. Склад та назви солей''<br>[[Image:Таблиця 7. Склад та назви солей.jpg|Склад та назви солей. фото]]<br><br>Як же взнати, яка сіль утвориться? Все залежить від кількості речовин, які реагують. Якщо є надлишок кислоти, то утворюється кисла сіль, якщо є надлишок лугу, — середня сіль. |
| - | | + | |
| - | <br>
| + | |
| | | | |
| - | [[Image:Солі.jpg]] | + | [[Image:Солі.jpg|Середні та кислі солі. фото]] |
| | | | |
| - | <u><br>Висновки</u><br>Солі мають немолекулярну будову. Це — продукти заміщення атомів Гідрогену в кислоті на атоми металу. Вони являють собою складні речовини, що містять атоми металу й кислотні залишки.<br>Назви солей утворюються від назв відповідних кислот.<br>Солі поділяють на середні (продукти повного заміщення Гідрогену кислоти на метал) і кислі (продукти неповного заміщення Гідрогену кислоти на метал).<br><br>
| + | ''Мал. 6. Середні та кислі солі.'' |
| | | | |
| - | <u>Завдання для самоконтролю</u><br>1. Напиши формули солей за їх назвою: а) кальцій хлорид; б) магній нітрат; в) алюміній сульфат; г) натрій силікат; д) цинк сульфід.<br>2. Напиши назви солей за їх формулами:<br>a)MgCO<sub>3</sub>; 6)CuCl<sub>2</sub>; в)СuСl; г) Na<sub>3</sub>PO<sub>4</sub>; д) Ba(NO<sub>3</sub>)<sub>2</sub>.<br>3. Із наведеного переліку формул речовин випиши окремо формули середніх і кислих солей і зазнач їх назви: | + | <u><br></u>'''Висновки'''<br>Солі мають немолекулярну будову. Це — продукти заміщення атомів Гідрогену в кислоті на атоми металу. Вони являють собою складні речовини, що містять атоми металу й кислотні залишки.<br>Назви солей утворюються від назв відповідних кислот.<br>Солі поділяють на середні (продукти повного заміщення Гідрогену кислоти на метал) і кислі (продукти неповного заміщення Гідрогену кислоти на метал).<br><br> |
| | | | |
| - | Fe<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>, FeS0<sub>4</sub>, Na<sub>2</sub>S0<sub>4</sub>, NaHS0<sub>4</sub>, K<sub>2</sub>C0<sub>3</sub>, CaHP0<sub>4</sub>, Ba<sub>3</sub>(P0<sub>4</sub>)<sub>2</sub>, Ca(H<sub>2</sub>P0<sub>4</sub>)<sub>2</sub>, Cr(N0<sub>3</sub>)<sub>3</sub>, NaHC0<sub>3</sub>.<br>
| + | '''Завдання для самоконтролю'''<br>''1. Напиши формули солей за їх назвою: а) кальцій хлорид; б) магній нітрат; в) алюміній сульфат; г) натрій силікат; д) цинк сульфід.<br>2. Напиши назви солей за їх формулами:<br>a)MgCO<sub>3</sub>; 6)CuCl<sub>2</sub>; в)СuСl; г) Na<sub>3</sub>PO<sub>4</sub>; д) Ba(NO<sub>3</sub>)<sub>2</sub>.<br>3. Із наведеного переліку формул речовин випиши окремо формули середніх і кислих солей і зазнач їх назви:'' |
| | | | |
| - | 4. Як ти думаєш, чому одноосновні кислоти не утворюють кислих солей? Відповідь мотивуй.<br>5. Яка сіль — середня чи кисла — утвориться внаслідок дії надлишку кислоти на основний оксид металу? Покажи на конкретному прикладі.<br><br> | + | ''Fe<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>, FeS0<sub>4</sub>, Na<sub>2</sub>S0<sub>4</sub>, NaHS0<sub>4</sub>, K<sub>2</sub>C0<sub>3</sub>, CaHP0<sub>4</sub>, Ba<sub>3</sub>(P0<sub>4</sub>)<sub>2</sub>, Ca(H<sub>2</sub>P0<sub>4</sub>)<sub>2</sub>, Cr(N0<sub>3</sub>)<sub>3</sub>, NaHC0<sub>3</sub>.<br>'' |
| | | | |
| - | ----
| + | ''4. Як ти думаєш, чому одноосновні кислоти не утворюють кислих солей? Відповідь мотивуй.<br>5. Яка сіль — середня чи кисла — утвориться внаслідок дії надлишку кислоти на основний оксид металу? Покажи на конкретному прикладі.<br>''<br> |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту'' |
| | | | |
| | <br> <sub>Матеріали по [[Хімія 8 клас|хімії]] для 8 класу, конспекти [[Гіпермаркет Знань - перший в світі!|уроків]], реферати та домашнє завдання по всім предметам </sub> <br> | | <br> <sub>Матеріали по [[Хімія 8 клас|хімії]] для 8 класу, конспекти [[Гіпермаркет Знань - перший в світі!|уроків]], реферати та домашнє завдання по всім предметам </sub> <br> |
Текущая версия на 06:37, 17 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Солі (середні), їх склад, назви
Склад солей. Ти вже знаєш, що в результаті багатьох реакцій, які відбуваються з оксидами, кислотами, основами, утворюються солі.
Солі — це складні речовини, до складу яких входять атоми металу й кислотні залишки.
Складаючи формулу солі, на першому місці треба написати хімічний символ металу, поруч — кислотний залишок, тоді зазначити валентність та розставити індекси. При цьому слід керуватися таким правилом:
сума одиниць валентності атомів металу має дорівнювати сумі одиниць валентності кислотних залишків.
Приклади реакцій, унаслідок яких утворюються солі:
Mg + H2S04 = MgS04 + Н2↑
Магній сульфат
CuO + 2НСІ = CuCI2 + Н20
Купрум(ІІ) хлорид
Ca(OH)2 + 2HN03 = Ca(N03)2 + 2H20
Кальцій нітрат

Мал. 5. Приклади реакцій, унаслідок яких утворюються солі.
Наприклад, тобі потрібно скласти формулу алюмінієвої солі сульфатної кислоти. Як треба діяти? Спершу напиши хімічний символ алюмінію Аl, поруч — кислотний залишок сульфатної кислоти H2S04, тобто S04. Над знаком Алюмінію напиши валентність 3 (визнач за періодичною системою хімічних елементів). Над кислотним залишком надпиши його валентність 2 (за основністю кислоти). За допомогою індексів зрівняй сумарні валентності. Найменше спільне кратне для чисел 3 і 2 дорівнює 6. Шукаємо індекс для Алюмінію, ділячи 6 на його валентність, дістаємо 2. Так само ділимо 6
на валентність кислотного залишку, дістаємо 3. Звідси формула
Al2(S04)3;
3-2 = 2-3.
При цьому пам'ятай, хоча ми виражаємо склад солей хімічними формулами, але в кристалах солі молекул немає. Формули солей передають не склад молекул, а співвідношення атомів металу й кислотного залишку. Для алюміній сульфату Al2(S04)3 таке співвідношення дорівнює 2 : 3. Отже, солі — речовини немолекулярної будови.
За формулами солей можна обчислювати значення відносної молекулярної (формульної) і молярної мас, пам'ятаючи при цьому, що реальних молекул у кристалах солей немає, вони побудовані з інших частинок — йонів.
Назви солей. За міжнародною хімічною номенклатурою назва солі складається з назви елемента-металу й латинської назви кислотного залишку. Звичайно ж латинська назва кислотного залишку походить від латинської назви кислоти, яка, у свою чергу, походить від латинської назви елемента, що утворює кислоту. При цьому назва солі безоксигенової кислоти має суфікс -ид (-ід), а оксигеновмісної — -ат в разі максимальної валентності кис-лотоутворюючого елемента і -іт у разі його нижчої валентності. Для металів, що мають змінну валентність, у дужках після назви металу римською цифрою зазначають його валентність у даній солі (табл. 7).
Розглядаючи формули солей за табл. 7, ти можеш зробити висновок, що солі — це продукти заміщення атомів Гідрогену в кислоті на атоми металу. Якщо кислота двох- чи багатоосновна, то атоми Гідрогену заміщуються не всі одночасно, а послідовно. Тоді може виникнути ситуація, коли один атом Гідрогену замістився на метал, а інший — залишився. У такому разі утворюється так звана кисла сіль, на відміну від солі середньої, яка атомів Гідрогену не містить:
2NaOH + H2S04 = Na2S04 + 2Н20
2 моль 1 моль Натрій сульфат
NaOH + H2S04 = NaHS04 + Н20
1 моль 1 моль Натрій гідрогенсульфат
Таблиця 7. Склад та назви солей
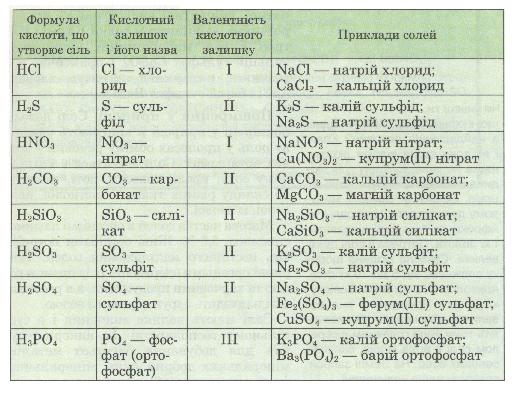
Як же взнати, яка сіль утвориться? Все залежить від кількості речовин, які реагують. Якщо є надлишок кислоти, то утворюється кисла сіль, якщо є надлишок лугу, — середня сіль.
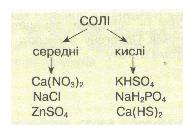
Мал. 6. Середні та кислі солі.
Висновки
Солі мають немолекулярну будову. Це — продукти заміщення атомів Гідрогену в кислоті на атоми металу. Вони являють собою складні речовини, що містять атоми металу й кислотні залишки.
Назви солей утворюються від назв відповідних кислот.
Солі поділяють на середні (продукти повного заміщення Гідрогену кислоти на метал) і кислі (продукти неповного заміщення Гідрогену кислоти на метал).
Завдання для самоконтролю
1. Напиши формули солей за їх назвою: а) кальцій хлорид; б) магній нітрат; в) алюміній сульфат; г) натрій силікат; д) цинк сульфід.
2. Напиши назви солей за їх формулами:
a)MgCO3; 6)CuCl2; в)СuСl; г) Na3PO4; д) Ba(NO3)2.
3. Із наведеного переліку формул речовин випиши окремо формули середніх і кислих солей і зазнач їх назви:
Fe2(S04)3, FeS04, Na2S04, NaHS04, K2C03, CaHP04, Ba3(P04)2, Ca(H2P04)2, Cr(N03)3, NaHC03.
4. Як ти думаєш, чому одноосновні кислоти не утворюють кислих солей? Відповідь мотивуй.
5. Яка сіль — середня чи кисла — утвориться внаслідок дії надлишку кислоти на основний оксид металу? Покажи на конкретному прикладі.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Матеріали по хімії для 8 класу, конспекти уроків, реферати та домашнє завдання по всім предметам
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|














