|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Будова електронних оболонок атомів хiмічних елементів. Стан електронів у атомі. Енергетичні рівні та підрівні''' <metakeywords>Хімія, клас, урок, на Тему, Будова електронних оболонок, атомів хiмічних елементів, Стан електронів у атомі, Енергетичні рівні, Енергетичні підрівні</metakeywords> <br><br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>> Будова електронних оболонок атомів хiмічних елементів. Стан електронів у атомі. Енергетичні рівні та підрівні''' <metakeywords>Хімія, клас, урок, на Тему, Будова електронних оболонок, атомів хiмічних елементів, Стан електронів у атомі, Енергетичні рівні, Енергетичні підрівні</metakeywords> <br><br> |
| | | | |
| | + | <br> |
| | | | |
| | + | '''БУДОВА ЕЛЕКТРОННОЇ ОБОЛОНКИ АТОМА'''<br><br>Ти вже знаєш, що [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|атом]] складається з [[Атом_і_атомне_ядро._Дослід_Резерфорда._Ядерна_модель_атома|ядра]] й [[Будова_атома._Електрон._Йон._Повні_уроки|електронів]], які утворюють електронну оболонку атома. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.<br>Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента |
| | | | |
| - | '''БУДОВА ЕЛЕКТРОННОЇ ОБОЛОНКИ АТОМА'''<br><br><u>Тобі треба<br>розуміти зміст понять:</u> електронна оболонка атома; енергетичний рівень (електронний шар);<br><u>знати:</u> закономірності розподілу електронів у атомах перших 20-ти елементів; зв'язок електронної будови атома з місцем елемента в періодичній системі;<br><u>уміти записувати:</u> електронні формули атомів хімічних елементів; графічні схеми розподілу електронів у атомах перших 20-ти елементів.<br><br>Ти вже знаєш, що атом складається з ядра й електронів, які утворюють електронну оболонку атома. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.<br>Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента
| + | [[Image:Р-елементи.jpg|р-елементи. фото]]<br> |
| | | | |
| - | [[Image:Р-елементи.jpg]]<br>
| + | ''Мал. 12. р-елементи.'' |
| | | | |
| - | <br>Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас енергії. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. А чим далі електрони від ядер, тим легше їх відірвати. Виходить, що в міру віддалення від ядра<br>атома запас енергії електрона збільшується (мал. 13).<br>[[Image:Мал. 13. Схема будови енергетичних рівнів.jpg]]<br>Мал. 13. Схема будови енергетичних рівнів<br><br>Електрони, що рухаються поблизу ядра, заслоняють (екранують) ядро від інших електронів, які притягуються до нього слабкіше і рухаються на більшій відстані від ядра. Так утворюються електронні шари в електронній оболонці атома. Кожний електронний шар складається з електронів з близькими значеннями енергії, тому електронні шари називають ще '''''енергетичними рівнями.'''''
| + | Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас [[Робота_та_енергія._Види_енергії:_механічна,_електрична,_атомна|енергії]]. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. А чим далі електрони від ядер, тим легше їх відірвати. Виходить, що в міру віддалення від ядра<br>атома запас енергії електрона збільшується (мал. 13).<br>[[Image:Мал. 13. Схема будови енергетичних рівнів.jpg|Схема будови енергетичних рівнів. фото]]<br>''Мал. 13. Схема будови енергетичних рівнів''<br><br>Електрони, що рухаються поблизу ядра, заслоняють (екранують) ядро від інших електронів, які притягуються до нього слабкіше і рухаються на більшій відстані від ядра. Так утворюються електронні шари в електронній оболонці атома. Кожний електронний шар складається з електронів з близькими значеннями енергії, тому електронні шари називають ще '''''енергетичними рівнями.''''' |
| | | | |
| - | <br>Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває хімічний елемент. Отже, електронна оболонка атомів елементів першого періоду містить один енергетичний рівень, другого періоду — два, третього — три і т. д. | + | <br>Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває [[Атоми_і_хімічні_елементи._Перевір_себе|хімічний елемент]]. Отже, електронна оболонка атомів елементів першого періоду містить один енергетичний рівень, другого періоду — два, третього — три і т. д. |
| | | | |
| - | Кожний енергетичний рівень складається з орбіталей певної форми: перший містить одну s-орбіталь, другий — s- і р-орбіталі, третій — s-, р-, d-орбіталі. Отже, зверни увагу: який номер рівня, стільки й форм орбіталей, що його утворюють.<br>Число орбіталей на енергетичних рівнях різне, воно дорівнює n<sup>2</sup>, де n — номер рівня. На першому рівні (n = 1) одна 8-орбіталь, на другому (n = 2) — чотири: одна s- і три р-орбіталі, на третьому (n = 3) — дев'ять: одна три р- і п'ять d-орбіталей (див. мал. 13). Зважаючи на те, що на кожній з орбіталей може перебувати не більше двох електронів, максимальна кількість електронів на тому чи іншому енергетичному рівні дорівнює 2n<sup>2</sup> (див. мал. 13). Схематично будову електронної оболонки атома можна показати так: | + | Кожний енергетичний рівень складається з орбіталей певної форми: перший містить одну s-орбіталь, другий — s- і р-орбіталі, третій — s-, р-, d-орбіталі. Отже, зверни увагу: який номер рівня, стільки й форм орбіталей, що його утворюють.<br>Число орбіталей на енергетичних рівнях різне, воно дорівнює n<sup>2</sup>, де n — номер рівня. На першому рівні (n = 1) одна 8-орбіталь, на другому (n = 2) — чотири: одна s- і три р-орбіталі, на третьому (n = 3) — дев'ять: одна три р- і п'ять d-орбіталей (див. мал. 13). Зважаючи на те, що на кожній з орбіталей може перебувати не більше двох електронів, максимальна кількість електронів на тому чи іншому енергетичному рівні дорівнює 2n<sup>2</sup> (див. мал. 13). |
| | | | |
| - | [[Image:Будовa електронної оболонки атома .jpg]]<br>Число ж електронів на зовнішньому енергетичному рівні електронної оболонки атома дорівнює номеру групи для хімічних елементів головних підгруп. Ці електрони називаються валентними. Саме вони визначають властивості елемента.
| + | Число ж електронів на зовнішньому енергетичному рівні електронної оболонки атома дорівнює номеру групи для хімічних елементів головних підгруп. Ці електрони називаються валентними. Саме вони визначають властивості елемента. |
| | | | |
| | <br>Тепер розглянемо конкретні приклади. Атом Гідрогену має найменший заряд ядра (+1), отже, й один електрон. Він розмішується на єдиній s-орбіталі, утворюючи перший енергетичний рівень (див. мал. 13). Таке уявлення можна передати за допомогою схеми | | <br>Тепер розглянемо конкретні приклади. Атом Гідрогену має найменший заряд ядра (+1), отже, й один електрон. Він розмішується на єдиній s-орбіталі, утворюючи перший енергетичний рівень (див. мал. 13). Таке уявлення можна передати за допомогою схеми |
| | | | |
| - | [[Image:Одноатомна орбіталь.jpg]]<br> | + | [[Image:Одноатомна орбіталь.jpg|схема. фото]]<br> |
| | | | |
| | і за допомогою електронної формули 1s<sup>1</sup>, де <br> | | і за допомогою електронної формули 1s<sup>1</sup>, де <br> |
| | | | |
| - | [[Image:Електронна формули 1s1.jpg]] | + | [[Image:Електронна формули 1s1.jpg|формула. фото]] |
| | | | |
| | <br> | | <br> |
| | | | |
| - | За Гідрогеном іде Гелій. Його атом містить ядро із зарядом +2, біля якого рухаються два електрони на тому самому першому енергетичному рівні:<br> | + | За [[Практичні_роботи:_1._Добування_вуглекислого_газу._Взаємоперетворення_карбонатів_і_гідрогенкарбонатів|Гідрогеном]] іде Гелій. Його атом містить ядро із зарядом +2, біля якого рухаються два електрони на тому самому першому енергетичному рівні:<br> |
| | | | |
| - | [[Image:Електронна формула He.jpg]] | + | [[Image:Електронна формула He.jpg|Гелій. фото]] |
| | | | |
| | Оскільки на першому енергетичному рівні може перебувати тільки два електрони, то в атомі Гелію перший рівень є завершеним.<br>В елементів другого періоду починає формуватися другий енергетичний рівень, на якому може перебувати не більше 8 електронів (див. мал. 13).<br>Спробуй самостійно записати електронні формули елементів другого періоду і покажи розподіл електронів за енергетичними комірками. Ось що виходить:<br> | | Оскільки на першому енергетичному рівні може перебувати тільки два електрони, то в атомі Гелію перший рівень є завершеним.<br>В елементів другого періоду починає формуватися другий енергетичний рівень, на якому може перебувати не більше 8 електронів (див. мал. 13).<br>Спробуй самостійно записати електронні формули елементів другого періоду і покажи розподіл електронів за енергетичними комірками. Ось що виходить:<br> |
| | | | |
| - | [[Image:LiBeBCNOFNeNaAl.jpg]]<br> | + | [[Image:LiBeBCNOFNeNaAl.jpg|Електронні формули. фото]]<br> |
| | + | |
| | + | ''Мал. 14. Електронні формули.'' |
| | | | |
| | Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра: спочатку s-, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей, то по два, утворюючи електронні пари з протилежними спінами | | Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра: спочатку s-, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей, то по два, утворюючи електронні пари з протилежними спінами |
| Строка 37: |
Строка 41: |
| | <br>Оскільки на зовнішньому енергетичному рівні не може бути більше 8 електронів, то в атомі Неону другий рівень є завершеним.<br>В електронній оболонці атомів елементів третього періоду починає формуватися третій енергетичний рівень. Згідно з формулою 2n<sup>2</sup> на ньому може бути максимально 18 електронів (див. мал. 13), але повністю забудуватися він не встигає (чому?). | | <br>Оскільки на зовнішньому енергетичному рівні не може бути більше 8 електронів, то в атомі Неону другий рівень є завершеним.<br>В електронній оболонці атомів елементів третього періоду починає формуватися третій енергетичний рівень. Згідно з формулою 2n<sup>2</sup> на ньому може бути максимально 18 електронів (див. мал. 13), але повністю забудуватися він не встигає (чому?). |
| | | | |
| - | [[Image:NaAlAr.jpg]]<br> | + | [[Image:NaAlAr.jpg|Електронні формули. фото]]<br> |
| - | | + | |
| - | <br>В атомі Аргону зовнішній енергетичний рівень містить 8 електронів, отже, він завершений. Проте забудова третього рівня цим не вичерпується, бо він може містити загалом 18 електронів, тобто ще 10 електронів на d-підрівні. Цей підрі-вень формуватиметься далі, у наступному періоді (вивчатиметься пізніше).<br>Записані вище електронні формули у поєднанні з графічними схемами розподілу електронів у так званих енергетичних комірках відбивають будову електронної І оболонки атома, його електронну конфігурацію.<br><br>Складаючи '''''схеми будови електронних оболонок атомів''''', керуйся таким алгоритмом:<br>1. Спершу визнач загальне число електронів на електронній оболонці за протонним числом елемента.<br>2. Далі визнач кількість енергетичних рівнів у електронній оболонці за номером періоду.<br>3. Визнач максимальну кількість електронів на кожному енергетичному рівні за формулою 2n<sup>2</sup> (на зовнішньому рівні — за номером групи для елементів головних підгруп).<br>4. Пригадай, що кількість форм орбіталей, які утворюють даний енергетичний рівень, дорівнює номеру цього рівня.<br>5. Не забудь, що на кожній орбіталі може перебувати максимум два електрони (з протилежними спінами).<br><br><br><u>ВИСНОВКИ</u><br>Електрони в атомі мають різну енергію зв'язку з ядром: чим вона більша, тим ближче до ядра розміщується електрон. У результаті електрони в атомі розподіляються шарами, на різних енергетичних рівнях. Максимальна кількість електронів на даному рівні дорівнює 2n<sup>2</sup>: на першому рівні може бути тільки два електрони, на другому — вісім. Такі рівні є завершеними.<br>Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває елемент.<br>Число електронів на зовнішньому рівні атома хімічного елемента дорівнює номеру групи (для елементів головних підгруп).<br>Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра (від 1-го до наступних): спочатку s-орбіталі, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей — то по два, утворюючи електронні пари з протилежними спінами. Розподіл електронів у атомі по орбіталях показує електронна формула.<br><br><u>Завдання для самоконтролю</u><br>1. Запиши електронні формули атомів Mg, Si, СІ і графічно зобрази розміщення електронів за енергетичними комірками.<br>2. Максимальне число електронів, які можуть займати Зв-підрівень, дорівнює<br>(а) 1; (б) 2; (в) 6; (г) 8.<br>3. На зовнішньому енергетичному рівні атома Сульфуру міститься електронів<br>(а) 2; (б) 4; (в) 6; (г) 8.<br>4. Скільки завершених енергетичних рівнів міститься в атомах хімічних елементів із протонними числами: а) 4; б) 10; в) 17? Відповідь поясни.<br>5. Число протонів у ядрі атома Феруму дорівнює (а) 2; (б) 8; (в) 26; (г) 56.<br>6. Заповнення електронами р-підрівня відбувається в атомі (а) Калію; (б) Сульфуру; (в) Гелію; (г) Алюмінію.<br>7. Число електронів на зовнішньому електронному р-підрівні атома Хлору дорівнює<br>(а) 7; (б) 3; (в) 5; (г) 6.<br>8. Елемент, атом якого має конфігурацію 1s<sup>2</sup>2s<sup>2</sup>p<sup>6</sup>3s<sup>2</sup>3p<sup>1</sup> — це (а) Аl; (б) Са; (в) СІ; (г) Na.<br><br><u>Додаткові завдання</u><br>9. Запиши електронну конфігурацію атома Калію.<br>10. Електронна конфігурація 1s<sup>2</sup>2s<sup>2</sup>2p<sup>6</sup>3s<sup>2</sup>3p<sup>6</sup>4s<sup>2</sup> відповідає атому<br>(а) Кальцію; (6) Калію; (в) Скандію; (г) Аргону.<br>Склади схему розподілу електронів даного атома за енергетичними комірками.<br>11*. Електронну конфігурацію атома інертного газу має<br>(а) Те<sup>2-</sup>; (б)Сu<sup>+</sup>; (в) Fe<sup>2+</sup>; (г)Сr<sup>3+</sup>.<br>12*. Число електронів у йоні Хрому <sup>52</sup><sub>24</sub>Сr<sup>3+</sup> дорівнює<br>(а) 21; (6) 24; (в) 27; (г) 52.<br>13*. Частинки Ne<sup>0</sup>, Na<sup>+</sup>, F<sup>- </sup>мають однакове<br>(а) нуклонне число; (в) число електронів;<br>(б) число нейтронів; (г) протонне число.<br>14*. Скорочена електронна конфігурація основного стану ...3d<sup>5</sup>4s<sup>2</sup>4p<sup>0</sup> відповідає атому із зарядом ядра<br>(а) 20; (б) 25; (в) 30; (г) 35.<br>15*. Серед наведених позначень електронних конфігурацій неможливими є<br>(а)1р<sup>1</sup>; (б)1s<sup>2</sup>; (в) 2d<sup>4</sup>; (г) 3f<sup>2</sup>.<br>Відповідь мотивуй.<br>16*. Одну вільну р-орбіталь має на зовнішньому електронному рівні атом <br>
| + | |
| - | | + | |
| - | (а) Берилію; (б) Алюмінію; (в) Карбону; (г) Скандію.
| + | |
| - | | + | |
| - | | + | |
| - | | + | |
| - | | + | |
| | | | |
| | + | ''Мал. 15. Електронні формули.'' |
| | | | |
| | + | <br>В атомі Аргону зовнішній енергетичний рівень містить 8 електронів, отже, він завершений. Проте забудова третього рівня цим не вичерпується, бо він може містити загалом 18 електронів, тобто ще 10 електронів на d-підрівні. Цей підрі-вень формуватиметься далі, у наступному періоді (вивчатиметься пізніше).<br>Записані вище електронні формули у поєднанні з графічними схемами розподілу електронів у так званих енергетичних комірках відбивають будову електронної І оболонки атома, його електронну конфігурацію.<br><br>Складаючи '''''схеми [[Тема_19._Будова_електронних_оболонок_атомів_хiмічних_елементів._Радіус_атома._Енергетичні_рівні_та_підрівні._Структура_періодичної_системи|будови електронних оболонок атомів]]''''', керуйся таким алгоритмом:<br>1. Спершу визнач загальне число електронів на електронній оболонці за протонним числом елемента.<br>2. Далі визнач кількість енергетичних рівнів у електронній оболонці за номером періоду.<br>3. Визнач максимальну кількість електронів на кожному енергетичному рівні за формулою 2n<sup>2</sup> (на зовнішньому рівні — за номером групи для елементів головних підгруп).<br>4. Пригадай, що кількість форм орбіталей, які утворюють даний енергетичний рівень, дорівнює номеру цього рівня.<br>5. Не забудь, що на кожній орбіталі може перебувати максимум два електрони (з протилежними спінами).<br><br><br>'''ВИСНОВКИ'''<br>Електрони в атомі мають різну енергію зв'язку з ядром: чим вона більша, тим ближче до ядра розміщується електрон. У результаті електрони в атомі розподіляються шарами, на різних енергетичних рівнях. Максимальна кількість електронів на даному рівні дорівнює 2n<sup>2</sup>: на першому рівні може бути тільки два електрони, на другому — вісім. Такі рівні є завершеними.<br>Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває елемент.<br>Число електронів на зовнішньому рівні атома хімічного елемента дорівнює номеру групи (для елементів головних підгруп).<br>Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра (від 1-го до наступних): спочатку s-орбіталі, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей — то по два, утворюючи електронні пари з протилежними спінами. Розподіл електронів у атомі по орбіталях показує електронна формула.<br><br>'''Завдання для самоконтролю'''<br>''1. Запиши електронні формули атомів Mg, Si, СІ і графічно зобрази розміщення електронів за енергетичними комірками.<br>2. Максимальне число електронів, які можуть займати Зв-підрівень, дорівнює<br>(а) 1; (б) 2; (в) 6; (г) 8.<br>3. На зовнішньому енергетичному рівні атома Сульфуру міститься електронів<br>(а) 2; (б) 4; (в) 6; (г) 8.<br>4. Скільки завершених енергетичних рівнів міститься в атомах хімічних елементів із протонними числами: а) 4; б) 10; в) 17? Відповідь поясни.<br>5. Число протонів у ядрі атома Феруму дорівнює (а) 2; (б) 8; (в) 26; (г) 56.<br>6. Заповнення електронами р-підрівня відбувається в атомі (а) Калію; (б) Сульфуру; (в) Гелію; (г) Алюмінію.<br>7. Число електронів на зовнішньому електронному р-підрівні атома Хлору дорівнює<br>(а) 7; (б) 3; (в) 5; (г) 6.<br>8. Елемент, атом якого має конфігурацію 1s<sup>2</sup>2s<sup>2</sup>p<sup>6</sup>3s<sup>2</sup>3p<sup>1</sup> — це (а) Аl; (б) Са; (в) СІ; (г) Na.''<br><br>'''Додаткові завдання'''<br>''9. Запиши електронну конфігурацію атома Калію.<br>10. Електронна конфігурація 1s<sup>2</sup>2s<sup>2</sup>2p<sup>6</sup>3s<sup>2</sup>3p<sup>6</sup>4s<sup>2</sup> відповідає атому<br>(а) Кальцію; (6) Калію; (в) Скандію; (г) Аргону.<br>Склади схему розподілу електронів даного атома за енергетичними комірками.<br>11*. Електронну конфігурацію атома інертного газу має<br>(а) Те<sup>2-</sup>; (б)Сu<sup>+</sup>; (в) Fe<sup>2+</sup>; (г)Сr<sup>3+</sup>.<br>12*. Число електронів у йоні Хрому <sup>52</sup><sub>24</sub>Сr<sup>3+</sup> дорівнює<br>(а) 21; (6) 24; (в) 27; (г) 52.<br>13*. Частинки Ne<sup>0</sup>, Na<sup>+</sup>, F<sup>- </sup>мають однакове<br>(а) нуклонне число; (в) число електронів;<br>(б) число нейтронів; (г) протонне число.<br>14*. Скорочена електронна конфігурація основного стану ...3d<sup>5</sup>4s<sup>2</sup>4p<sup>0</sup> відповідає атому із зарядом ядра<br>(а) 20; (б) 25; (в) 30; (г) 35.<br>15*. Серед наведених позначень електронних конфігурацій неможливими є<br>(а)1р<sup>1</sup>; (б)1s<sup>2</sup>; (в) 2d<sup>4</sup>; (г) 3f<sup>2</sup>.<br>Відповідь мотивуй.<br>16*. Одну вільну р-орбіталь має на зовнішньому електронному рівні атом <br>'' |
| | | | |
| | + | ''(а) Берилію; (б) Алюмінію; (в) Карбону; (г) Скандію.'' |
| | | | |
| | + | <br> |
| | | | |
| - | '''СТАН ЕЛЕКТРОНІВ У АТОМІ'''<br><br><u>Тобі треба<br>мати уявлення:</u> про рух електронів у атомі; спін електрона;<br><u>розуміти суть понять:</u> орбіталь; електронна густина;<br><u>уміти:</u> схематично позначати орбіталь з двома електронами, що мають протилежні спіни; характеризувати s- і р-орбіталі.<br><br><br>Відомо, що в атомі будь-якого елемента електрони рухаються. Вони не можуть бути нерухомими, бо під дією сили притягання до позитивно зарядженого ядра вони впали б на ядро. Але електрони не обертаються навколо ядра, як думали раніше (згадай планетарну (ядерну) модель атома Е. Резерфорда. Як же вони рухаються в атомі? | + | '''СТАН ЕЛЕКТРОНІВ У АТОМІ'''<br><br>Відомо, що в атомі будь-якого елемента [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|електрони]] рухаються. Вони не можуть бути нерухомими, бо під дією сили притягання до позитивно зарядженого ядра вони впали б на ядро. Але електрони не обертаються навколо ядра, як думали раніше (згадай планетарну (ядерну) модель атома Е. Резерфорда. Як же вони рухаються в атомі? |
| | | | |
| | Щоб зрозуміти стан електрона в атомі, треба взяти до уваги подвійну природу електрона і той факт, що світ атома — це мікросвіт. Він не підкоряється законам, вияв яких ми звикли спостерігати в житті, тобто в умовах макросвіту. Рух електрона в атомі неможливо описати певною траєкторією (неперервною лінією, яку описує матеріальна точка як тіло під час руху). Можна говорити лише про більшу чи меншу ймовірність перебування електрона в обмеженому об'ємі простору біля ядра (можлива й нульова ймовірність). Рухаючись в атомі, електрон займає тривимірну ділянку простору біля ядра, що називається атомною орбіталлю.<br> | | Щоб зрозуміти стан електрона в атомі, треба взяти до уваги подвійну природу електрона і той факт, що світ атома — це мікросвіт. Він не підкоряється законам, вияв яких ми звикли спостерігати в житті, тобто в умовах макросвіту. Рух електрона в атомі неможливо описати певною траєкторією (неперервною лінією, яку описує матеріальна точка як тіло під час руху). Можна говорити лише про більшу чи меншу ймовірність перебування електрона в обмеженому об'ємі простору біля ядра (можлива й нульова ймовірність). Рухаючись в атомі, електрон займає тривимірну ділянку простору біля ядра, що називається атомною орбіталлю.<br> |
| Строка 59: |
Строка 59: |
| | Окрім руху біля ядра, електрон має ще свій власний рух — спін. Спрощено спін (від англ. spin — обертання) можна уявити як рух електрона навколо власної осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо власної осі за годинниковою стрілкою, а інший — проти годинникової стрілки), то це електрони з антипаралельними спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує умови для взаємного притягання електронів. | | Окрім руху біля ядра, електрон має ще свій власний рух — спін. Спрощено спін (від англ. spin — обертання) можна уявити як рух електрона навколо власної осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо власної осі за годинниковою стрілкою, а інший — проти годинникової стрілки), то це електрони з антипаралельними спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує умови для взаємного притягання електронів. |
| | | | |
| - | На одній орбіталі може перебувати лише два електрони, які мають протилежні спіни. Схематично атомну орбіталь позначають так:<br>[[Image:Комірка.jpg]]<br>де квадрат (комірка) — це орбіталь, а стрілки — електрони з протилежними спінами. Одноелектронна орбіталь зображується так: | + | На одній орбіталі може перебувати лише два електрони, які мають протилежні спіни. Схематично атомну орбіталь позначають так:<br>[[Image:Комірка.jpg|схема. фото]]<br>де квадрат (комірка) — це орбіталь, а стрілки — електрони з протилежними спінами. |
| - | | + | |
| - | [[Image:Одноелектронна орбіталь .jpg]]
| + | |
| | | | |
| | <br> | | <br> |
| Строка 67: |
Строка 65: |
| | '''Характеристика орбіталей.''' Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його електронна хмара (орбіталь) менша за розміром, але щільніша (електронна густина більша). | | '''Характеристика орбіталей.''' Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його електронна хмара (орбіталь) менша за розміром, але щільніша (електронна густина більша). |
| | | | |
| - | Орбіталі (електронні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись біля ядра, утворює електронну хмару сферичної форми (форма кулі). Такі орбіталі позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають s-електронами (мал. 11).<br><br>[[Image:Мал. 11. Форми s- і р-орбіталей.jpg]] | + | Орбіталі (електронні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись біля ядра, утворює електронну хмару сферичної форми (форма кулі). Такі орбіталі позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають s-електронами (мал. 16).<br><br>[[Image:Мал. 11. Форми s- і р-орбіталей.jpg|Форми s- і р-орбіталей. фото]] |
| | | | |
| - | Мал. 11. Форми s- і р-орбіталей<br><br><br>Орбіталі, що мають сферичну форму, називаються s-орбіта-лями<br>р-Орбіталі мають гантелеподібну форму<br>Проте орбіталі можуть мати й іншу форму, наприклад форму гантелі (об'ємної «вісімки») або ще складнішу. Такі орбіталі позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами (див. мал. 11). Центри орбіталей збігаються з центром ядра.<br>р-Орбіталі відрізняються одна від одної розміщенням у просторі: вони розміщуються вздовж трьох взаємно перпендикулярних осей координат (мал. 12). Орбіталі складніших форм позначаються буквами d, f та ін.<br><br>[[Image:Мал. 12. Схема взаємного розміщення р-орбіталей у просторі .jpg]]<br>Мал. 12. Схема взаємного розміщення р-орбіталей у просторі | + | ''Мал. 16. Форми s- і р-орбіталей''<br><br><br>Орбіталі, що мають сферичну форму, називаються s-орбіта-лями<br>р-Орбіталі мають гантелеподібну форму<br>Проте орбіталі можуть мати й іншу форму, наприклад форму гантелі (об'ємної «вісімки») або ще складнішу. Такі орбіталі позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами (див. мал. 11). Центри орбіталей збігаються з центром ядра.<br>р-Орбіталі відрізняються одна від одної розміщенням у просторі: вони розміщуються вздовж трьох взаємно перпендикулярних осей координат. |
| | | | |
| - | <br>Орбіталі різних форм відрізняються між собою ще й силою притягання до ядра, s-Електрони, орбіталі яких мають сферичну форму, притягуються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі. А електрони з іще складнішими формами орбіталей притягуються ще слабкіше.<br><br><br><u>ВИСНОВКИ</u><br>Електрони в атомі перебувають у постійному русі, але вони не обертаються навколо ядра, як планети навколо Сонця. Простежити шлях, по якому рухається електрон, неможливо, бо в нього немає траєкторії руху. Електрон займає тривимірну ділянку простору біля ядра, в якій його перебування найімовірніше. Таку ділянку простору прийнято називати орбіталлю.<br>Орбіталі бувають різної форми — s-, р-, d-, f-орбіталі. Орбіталі, що мають сферичну форму, називаються s-орбіталя-ми. р-Орбіталі мають гантелеподібну форму. Вони взаємно перпендикулярно орієнтовані у просторі вздовж осей х, у і z і позначаються відповідно рх, ру, pz. Найсильніше притягуються до ядра s-орбіталі, р-орбіталі слабкіше і т. д.<br>На одній орбіталі може перебувати не більше двох електронів.<br><br><u><br>Завдання для самоконтролю</u><br>1. Як ти уявляєш рух електрона в атомі хімічного елемента? Відповідь обґрунтуй.<br>2. Яку форму має: а) s-орбіталь; б) р-орбіталь? Намалюй їхні моделі.<br>3. Накресли три осі координат і намалюй уздовж них три р-орбіталі.<br>4. Виліпи з пластиліну модель s-орбіталі. За допомогою сірників зобрази її розміщення відносно осей координат. Так само виготуй моделі р-орбіталей і розмісти їх у просторі одну відносно одної.<br>
| + | Орбіталі різних форм відрізняються між собою ще й силою притягання до ядра, s-Електрони, орбіталі яких мають сферичну форму, притягуються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі. А електрони з іще складнішими формами орбіталей притягуються ще слабкіше.<br><br><br>'''ВИСНОВКИ'''<br>Електрони в атомі перебувають у постійному русі, але вони не обертаються навколо ядра, як планети навколо Сонця. Простежити шлях, по якому рухається електрон, неможливо, бо в нього немає траєкторії руху. Електрон займає тривимірну ділянку простору біля ядра, в якій його перебування найімовірніше. Таку ділянку простору прийнято називати орбіталлю.<br>Орбіталі бувають різної форми — s-, р-, d-, f-орбіталі. Орбіталі, що мають сферичну форму, називаються s-орбіталя-ми. р-Орбіталі мають гантелеподібну форму. Вони взаємно перпендикулярно орієнтовані у просторі вздовж осей х, у і z і позначаються відповідно рх, ру, pz. Найсильніше притягуються до ядра s-орбіталі, р-орбіталі слабкіше і т. д.<br>На одній орбіталі може перебувати не більше двох електронів.<br><br><u><br></u>'''Завдання для самоконтролю'''<br>''1. Як ти уявляєш рух електрона в атомі хімічного елемента? Відповідь обґрунтуй.<br>2. Яку форму має: а) s-орбіталь; б) р-орбіталь? Намалюй їхні моделі.<br>3. Накресли три осі координат і намалюй уздовж них три р-орбіталі.<br>4. Виліпи з пластиліну модель s-орбіталі. За допомогою сірників зобрази її розміщення відносно осей координат. Так само виготуй моделі р-орбіталей і розмісти їх у просторі одну відносно одної.<br>'' |
| | | | |
| | <br> | | <br> |
| | | | |
| - | ----
| + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту<br>'' |
| - | | + | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту<br> | + | |
| | | | |
| | <br> <sub>Хімія 8 клас [[Хімія|онлайн]], підручники по всім [[Гіпермаркет Знань - перший в світі!|предметам]], плани уроків з хімії</sub> <br> | | <br> <sub>Хімія 8 клас [[Хімія|онлайн]], підручники по всім [[Гіпермаркет Знань - перший в світі!|предметам]], плани уроків з хімії</sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> | | <br> |
Текущая версия на 05:52, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>> Будова електронних оболонок атомів хiмічних елементів. Стан електронів у атомі. Енергетичні рівні та підрівні
БУДОВА ЕЛЕКТРОННОЇ ОБОЛОНКИ АТОМА
Ти вже знаєш, що атом складається з ядра й електронів, які утворюють електронну оболонку атома. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.
Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента
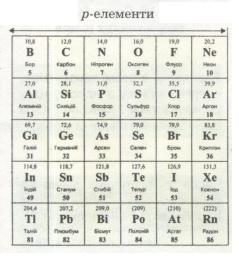
Мал. 12. р-елементи.
Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас енергії. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. А чим далі електрони від ядер, тим легше їх відірвати. Виходить, що в міру віддалення від ядра
атома запас енергії електрона збільшується (мал. 13).
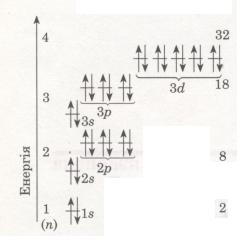
Мал. 13. Схема будови енергетичних рівнів
Електрони, що рухаються поблизу ядра, заслоняють (екранують) ядро від інших електронів, які притягуються до нього слабкіше і рухаються на більшій відстані від ядра. Так утворюються електронні шари в електронній оболонці атома. Кожний електронний шар складається з електронів з близькими значеннями енергії, тому електронні шари називають ще енергетичними рівнями.
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває хімічний елемент. Отже, електронна оболонка атомів елементів першого періоду містить один енергетичний рівень, другого періоду — два, третього — три і т. д.
Кожний енергетичний рівень складається з орбіталей певної форми: перший містить одну s-орбіталь, другий — s- і р-орбіталі, третій — s-, р-, d-орбіталі. Отже, зверни увагу: який номер рівня, стільки й форм орбіталей, що його утворюють.
Число орбіталей на енергетичних рівнях різне, воно дорівнює n2, де n — номер рівня. На першому рівні (n = 1) одна 8-орбіталь, на другому (n = 2) — чотири: одна s- і три р-орбіталі, на третьому (n = 3) — дев'ять: одна три р- і п'ять d-орбіталей (див. мал. 13). Зважаючи на те, що на кожній з орбіталей може перебувати не більше двох електронів, максимальна кількість електронів на тому чи іншому енергетичному рівні дорівнює 2n2 (див. мал. 13).
Число ж електронів на зовнішньому енергетичному рівні електронної оболонки атома дорівнює номеру групи для хімічних елементів головних підгруп. Ці електрони називаються валентними. Саме вони визначають властивості елемента.
Тепер розглянемо конкретні приклади. Атом Гідрогену має найменший заряд ядра (+1), отже, й один електрон. Він розмішується на єдиній s-орбіталі, утворюючи перший енергетичний рівень (див. мал. 13). Таке уявлення можна передати за допомогою схеми
і за допомогою електронної формули 1s1, де

За Гідрогеном іде Гелій. Його атом містить ядро із зарядом +2, біля якого рухаються два електрони на тому самому першому енергетичному рівні:

Оскільки на першому енергетичному рівні може перебувати тільки два електрони, то в атомі Гелію перший рівень є завершеним.
В елементів другого періоду починає формуватися другий енергетичний рівень, на якому може перебувати не більше 8 електронів (див. мал. 13).
Спробуй самостійно записати електронні формули елементів другого періоду і покажи розподіл електронів за енергетичними комірками. Ось що виходить:
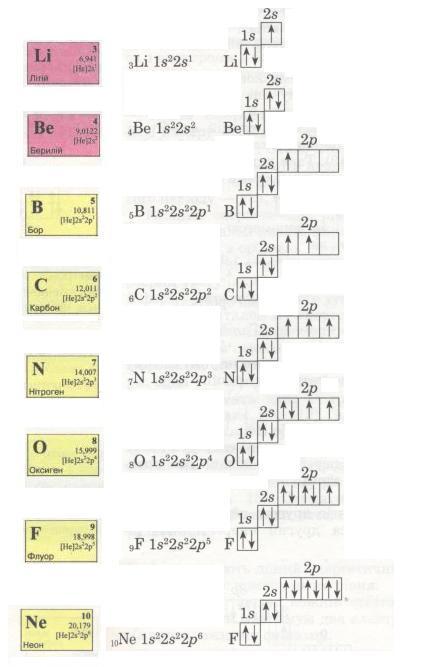
Мал. 14. Електронні формули.
Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра: спочатку s-, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей, то по два, утворюючи електронні пари з протилежними спінами
Оскільки на зовнішньому енергетичному рівні не може бути більше 8 електронів, то в атомі Неону другий рівень є завершеним.
В електронній оболонці атомів елементів третього періоду починає формуватися третій енергетичний рівень. Згідно з формулою 2n2 на ньому може бути максимально 18 електронів (див. мал. 13), але повністю забудуватися він не встигає (чому?).
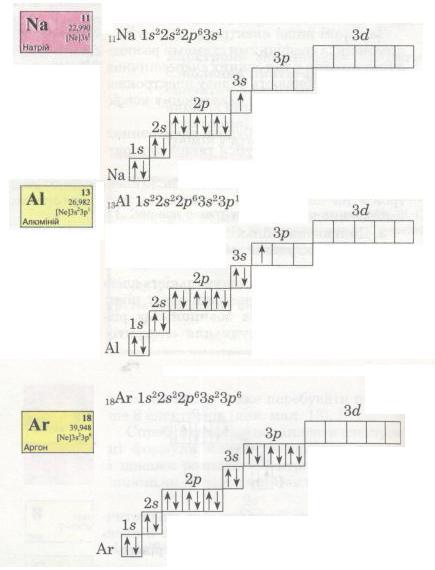
Мал. 15. Електронні формули.
В атомі Аргону зовнішній енергетичний рівень містить 8 електронів, отже, він завершений. Проте забудова третього рівня цим не вичерпується, бо він може містити загалом 18 електронів, тобто ще 10 електронів на d-підрівні. Цей підрі-вень формуватиметься далі, у наступному періоді (вивчатиметься пізніше).
Записані вище електронні формули у поєднанні з графічними схемами розподілу електронів у так званих енергетичних комірках відбивають будову електронної І оболонки атома, його електронну конфігурацію.
Складаючи схеми будови електронних оболонок атомів, керуйся таким алгоритмом:
1. Спершу визнач загальне число електронів на електронній оболонці за протонним числом елемента.
2. Далі визнач кількість енергетичних рівнів у електронній оболонці за номером періоду.
3. Визнач максимальну кількість електронів на кожному енергетичному рівні за формулою 2n2 (на зовнішньому рівні — за номером групи для елементів головних підгруп).
4. Пригадай, що кількість форм орбіталей, які утворюють даний енергетичний рівень, дорівнює номеру цього рівня.
5. Не забудь, що на кожній орбіталі може перебувати максимум два електрони (з протилежними спінами).
ВИСНОВКИ
Електрони в атомі мають різну енергію зв'язку з ядром: чим вона більша, тим ближче до ядра розміщується електрон. У результаті електрони в атомі розподіляються шарами, на різних енергетичних рівнях. Максимальна кількість електронів на даному рівні дорівнює 2n2: на першому рівні може бути тільки два електрони, на другому — вісім. Такі рівні є завершеними.
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває елемент.
Число електронів на зовнішньому рівні атома хімічного елемента дорівнює номеру групи (для елементів головних підгруп).
Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра (від 1-го до наступних): спочатку s-орбіталі, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей — то по два, утворюючи електронні пари з протилежними спінами. Розподіл електронів у атомі по орбіталях показує електронна формула.
Завдання для самоконтролю
1. Запиши електронні формули атомів Mg, Si, СІ і графічно зобрази розміщення електронів за енергетичними комірками.
2. Максимальне число електронів, які можуть займати Зв-підрівень, дорівнює
(а) 1; (б) 2; (в) 6; (г) 8.
3. На зовнішньому енергетичному рівні атома Сульфуру міститься електронів
(а) 2; (б) 4; (в) 6; (г) 8.
4. Скільки завершених енергетичних рівнів міститься в атомах хімічних елементів із протонними числами: а) 4; б) 10; в) 17? Відповідь поясни.
5. Число протонів у ядрі атома Феруму дорівнює (а) 2; (б) 8; (в) 26; (г) 56.
6. Заповнення електронами р-підрівня відбувається в атомі (а) Калію; (б) Сульфуру; (в) Гелію; (г) Алюмінію.
7. Число електронів на зовнішньому електронному р-підрівні атома Хлору дорівнює
(а) 7; (б) 3; (в) 5; (г) 6.
8. Елемент, атом якого має конфігурацію 1s22s2p63s23p1 — це (а) Аl; (б) Са; (в) СІ; (г) Na.
Додаткові завдання
9. Запиши електронну конфігурацію атома Калію.
10. Електронна конфігурація 1s22s22p63s23p64s2 відповідає атому
(а) Кальцію; (6) Калію; (в) Скандію; (г) Аргону.
Склади схему розподілу електронів даного атома за енергетичними комірками.
11*. Електронну конфігурацію атома інертного газу має
(а) Те2-; (б)Сu+; (в) Fe2+; (г)Сr3+.
12*. Число електронів у йоні Хрому 5224Сr3+ дорівнює
(а) 21; (6) 24; (в) 27; (г) 52.
13*. Частинки Ne0, Na+, F- мають однакове
(а) нуклонне число; (в) число електронів;
(б) число нейтронів; (г) протонне число.
14*. Скорочена електронна конфігурація основного стану ...3d54s24p0 відповідає атому із зарядом ядра
(а) 20; (б) 25; (в) 30; (г) 35.
15*. Серед наведених позначень електронних конфігурацій неможливими є
(а)1р1; (б)1s2; (в) 2d4; (г) 3f2.
Відповідь мотивуй.
16*. Одну вільну р-орбіталь має на зовнішньому електронному рівні атом
(а) Берилію; (б) Алюмінію; (в) Карбону; (г) Скандію.
СТАН ЕЛЕКТРОНІВ У АТОМІ
Відомо, що в атомі будь-якого елемента електрони рухаються. Вони не можуть бути нерухомими, бо під дією сили притягання до позитивно зарядженого ядра вони впали б на ядро. Але електрони не обертаються навколо ядра, як думали раніше (згадай планетарну (ядерну) модель атома Е. Резерфорда. Як же вони рухаються в атомі?
Щоб зрозуміти стан електрона в атомі, треба взяти до уваги подвійну природу електрона і той факт, що світ атома — це мікросвіт. Він не підкоряється законам, вияв яких ми звикли спостерігати в житті, тобто в умовах макросвіту. Рух електрона в атомі неможливо описати певною траєкторією (неперервною лінією, яку описує матеріальна точка як тіло під час руху). Можна говорити лише про більшу чи меншу ймовірність перебування електрона в обмеженому об'ємі простору біля ядра (можлива й нульова ймовірність). Рухаючись в атомі, електрон займає тривимірну ділянку простору біля ядра, що називається атомною орбіталлю.
Ділянка простору поблизу ядра, в якій найімовірніше перебування електрона, називається орбіталлю.
Зрозуміло, що чітко визначити межі орбіталі неможливо, вони розпливчасті. Електрон заповнює простір поблизу ядра у формі хвилі, яку можна уявити як «електронну хмару». Негативний заряд електрона виявляється «розмазаним» в усьому об'ємі простору біля ядра, яке оточене тривимірною електронною хмарою. Густина електронної хмари різна в різних місцях. У тих місцях, куди електрон потрапляє найчастіше, утворюється зона найбільшої електронної густини. У міру віддалення від ядра електронна густина дуже швидко зменшується й стає такою малою, що нею можна знехтувати.
Окрім руху біля ядра, електрон має ще свій власний рух — спін. Спрощено спін (від англ. spin — обертання) можна уявити як рух електрона навколо власної осі. Якщо два електрони мають однакові напрямки обертання, то говорять, що це електрони з паралельними спінами, а якщо напрямки обертання у них протилежні (один електрон обертається навколо власної осі за годинниковою стрілкою, а інший — проти годинникової стрілки), то це електрони з антипаралельними спінами. Два електрони з протилежними спінами створюють навколо себе магнітне поле з протилежно спрямованими силовими лініями, що забезпечує умови для взаємного притягання електронів.
На одній орбіталі може перебувати лише два електрони, які мають протилежні спіни. Схематично атомну орбіталь позначають так:
де квадрат (комірка) — це орбіталь, а стрілки — електрони з протилежними спінами.
Характеристика орбіталей. Якщо йдеться про ту частину електронної хмари (орбіталі), де її густина найбільша, то можна говорити про її розмір і форму. Так, залежно від величини енергії електронні хмари розрізняються за розмірами. Чим сильніше притягається електрон до ядра, тим його електронна хмара (орбіталь) менша за розміром, але щільніша (електронна густина більша).
Орбіталі (електронні хмари) розрізняються не лише за розмірами, а й за формою. Так, єдиний електрон в атомі Гідрогену, рухаючись біля ядра, утворює електронну хмару сферичної форми (форма кулі). Такі орбіталі позначають буквою s, а електрони, орбіталі яких мають сферичну форму, називають s-електронами (мал. 16).
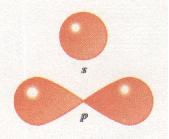
Мал. 16. Форми s- і р-орбіталей
Орбіталі, що мають сферичну форму, називаються s-орбіта-лями
р-Орбіталі мають гантелеподібну форму
Проте орбіталі можуть мати й іншу форму, наприклад форму гантелі (об'ємної «вісімки») або ще складнішу. Такі орбіталі позначають буквою р, а електрони, орбіталі яких мають гантелеподібну форму, називають р-електронами (див. мал. 11). Центри орбіталей збігаються з центром ядра.
р-Орбіталі відрізняються одна від одної розміщенням у просторі: вони розміщуються вздовж трьох взаємно перпендикулярних осей координат.
Орбіталі різних форм відрізняються між собою ще й силою притягання до ядра, s-Електрони, орбіталі яких мають сферичну форму, притягуються до ядра сильніше, ніж р-електрони, орбіталі яких мають форму гантелі. А електрони з іще складнішими формами орбіталей притягуються ще слабкіше.
ВИСНОВКИ
Електрони в атомі перебувають у постійному русі, але вони не обертаються навколо ядра, як планети навколо Сонця. Простежити шлях, по якому рухається електрон, неможливо, бо в нього немає траєкторії руху. Електрон займає тривимірну ділянку простору біля ядра, в якій його перебування найімовірніше. Таку ділянку простору прийнято називати орбіталлю.
Орбіталі бувають різної форми — s-, р-, d-, f-орбіталі. Орбіталі, що мають сферичну форму, називаються s-орбіталя-ми. р-Орбіталі мають гантелеподібну форму. Вони взаємно перпендикулярно орієнтовані у просторі вздовж осей х, у і z і позначаються відповідно рх, ру, pz. Найсильніше притягуються до ядра s-орбіталі, р-орбіталі слабкіше і т. д.
На одній орбіталі може перебувати не більше двох електронів.
Завдання для самоконтролю
1. Як ти уявляєш рух електрона в атомі хімічного елемента? Відповідь обґрунтуй.
2. Яку форму має: а) s-орбіталь; б) р-орбіталь? Намалюй їхні моделі.
3. Накресли три осі координат і намалюй уздовж них три р-орбіталі.
4. Виліпи з пластиліну модель s-орбіталі. За допомогою сірників зобрази її розміщення відносно осей координат. Так само виготуй моделі р-орбіталей і розмісти їх у просторі одну відносно одної.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Хімія 8 клас онлайн, підручники по всім предметам, плани уроків з хімії
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|



















