|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Характеристика хiмічних елементів малих періодів за їх місцем у періодичній системі та будовою атома''' <metakeywords>Хімія, клас, урок, на Тему, Характеристика хiмічних елементів, малих періодів, за їх місцем, у періодичній системі, та будовою атома</metakeywords> <br><br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Характеристика хiмічних елементів малих періодів за їх місцем у періодичній системі та будовою атома''' <metakeywords>Хімія, клас, урок, на Тему, Характеристика хiмічних елементів, малих періодів, за їх місцем, у періодичній системі, та будовою атома</metakeywords> <br><br>Існує понад 500 різних видів зображення [[41._Періодичний_закон_та_періодична_система_хімічних_елементів_Д._І._Менделєєва|періодичної системи]] — у вигляді таблиць, графіків, схем тощо. Найпоширенішими є табличні варіанти. Один із них ти вже знаєш. Це — короткоперіодний варіант, або коротка форма періодичної системи. Використовується ще довгоперіодний варіант, або довга форма періодичної системи. Він також був розроблений Д. І. Менделєєвим.<br>Нині у світі великого поширення набула довга форма. Вона дедалі стає популярнішою, оскільки краще узгоджується з будовою атомів хімічних елементів. Але за своєю суттю і коротка, і довга форми періодичної системи в цілому ідентичні (тотожні, рівнозначні). Вони доповнюють одна одну. Але в їх структурі є деякі відмінності.<br>У довгій формі періоди займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи (позначені рожевим кольором), в атомах яких заповнюються s-орбіталі (порівняй з короткою формою періодичної системи). Праворуч розміщуються р-елементи (позначені жовтим кольором). У s- і р-елементів забудовується зовнішній енергетичний рівень.<br>У середній частині періодів розміщуються перехідні елементи (синій колір), в атомах яких заповнюються d-орбіталі передзовнішнього рівня.<br>Родини лантаноїдів та актиноїдів (зелений колір) — це f-елементи. В їх атомах заповнюється третій ззовні рівень. Як правило, ці родини виносять за межі таблиці, як у короткій, так і в довгій формах. Відмінність у послідовності заповнення енергетичних рівнів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів.<br> |
| | | | |
| - | <br>
| + | ''Періодична повторюваність будови зовнішніх енергетичних рівнів атомів є причиною періодичної зміни властивостей хімічних елементів. У цьому полягає фізична суть [[Тема_16._Періодичний_закон_та_періодична_система_хімічних_елементів_Д._І._Менделєєва|періодичного закону]], яка не залежить від форми подання періодичної системи елементів.''<br> |
| - | | + | |
| - | <u>Тобі треба<br>мати уявлення:</u> про довгу форму періодичної системи;<br><u>знати:</u> зв'язок періодичної системи елементів з будовою їх атомів; структуру довгої форми періодичної системи;<br><u>уміти:</u> характеризувати елемент за його місцем у періодичній системі.<br><br><br>Існує понад 500 різних видів зображення періодичної системи — у вигляді таблиць, графіків, схем тощо. Найпоширенішими є табличні варіанти. Один із них ти вже знаєш. Це — короткоперіодний варіант, або коротка форма періодичної системи. Використовується ще довгоперіодний варіант, або довга форма періодичної системи. Він також був розроблений Д. І. Менделєєвим.<br>Нині у світі великого поширення набула довга форма. Вона дедалі стає популярнішою, оскільки краще узгоджується з будовою атомів хімічних елементів. Але за своєю суттю і коротка, і довга форми періодичної системи в цілому ідентичні (тотожні, рівнозначні). Вони доповнюють одна одну. Але в їх структурі є деякі відмінності.<br>У довгій формі періоди займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи (позначені рожевим кольором), в атомах яких заповнюються s-орбіталі (порівняй з короткою формою періодичної системи). Праворуч розміщуються р-елементи (позначені жовтим кольором). У s- і р-елементів забудовується зовнішній енергетичний рівень.<br>У середній частині періодів розміщуються перехідні елементи (синій колір), в атомах яких заповнюються d-орбіталі передзовнішнього рівня.<br>Родини лантаноїдів та актиноїдів (зелений колір) — це f-елементи. В їх атомах заповнюється третій ззовні рівень. Як правило, ці родини виносять за межі таблиці, як у короткій, так і в довгій формах. Відмінність у послідовності заповнення енергетичних рівнів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів.<br>
| + | |
| - | | + | |
| - | ''Періодична повторюваність будови зовнішніх енергетичних рівнів атомів є причиною періодичної зміни властивостей хімічних елементів. У цьому полягає фізична суть періодичного закону, яка не залежить від форми подання періодичної системи елементів.''<br> | + | |
| | | | |
| - | Знаючи місце елемента в періодичній системі, можна судити про будову його атома, а відтак — і про властивості простої речовини, утвореної цим елементом, характер його оксиду й гідрату оксиду тощо.<br><br>• Користуючись довгою формою періодичної системи, схарактеризуй хімічний елемент Натрій. Що ти можеш сказати про нього на підставі того місця, яке він займає у періодичній системі? | + | Знаючи місце елемента в періодичній системі, можна судити про [[42._Будова_атома:_ядро_і_електронна_оболонка._Склад_атомних_ядер._Протонне_число._Нуклонне_число._Сучасне_формулювання_періодичного_закону|будову його атома]], а відтак — і про властивості простої речовини, утвореної цим елементом, характер його оксиду й гідрату оксиду тощо.<br><br>''• Користуючись довгою формою періодичної системи, схарактеризуй хімічний елемент Натрій. Що ти можеш сказати про нього на підставі того місця, яке він займає у періодичній системі?'' |
| | | | |
| | <br>Перевір себе. Ось що у тебе повинно вийти.<br>Натрій Na — хімічний елемент, розміщений у 3-му періоді, в 1А групі. Протонне число (порядковий номер) — 11. Відносна атомна маса A<sub>r</sub>(Na) = 23.<br> | | <br>Перевір себе. Ось що у тебе повинно вийти.<br>Натрій Na — хімічний елемент, розміщений у 3-му періоді, в 1А групі. Протонне число (порядковий номер) — 11. Відносна атомна маса A<sub>r</sub>(Na) = 23.<br> |
| | | | |
| - | Ядро атома Натрію містить 11 протонів, оскільки заряд ядра +11, і 23 - 11 = = 12 нейтронів. В атомі Натрію є 11 електронів, які розподіляються на 3-х енергетичних рівнях (згідно з номером періоду): на першому рівні 2 s-електрони, на другому — 8 (2 s і 6 р-електронів), на третьому — 1 s-електрон (який номер рівня, стільки й форм орбіта лей). Отже, Натрій — s-елемент, в його атомі починає формуватися 3-й рівень.<br> | + | [[Атомное_ядро|Ядро атома]] Натрію містить 11 протонів, оскільки заряд ядра +11, і 23 - 11 = = 12 нейтронів. В атомі Натрію є 11 електронів, які розподіляються на 3-х енергетичних рівнях (згідно з номером періоду): на першому рівні 2 s-електрони, на другому — 8 (2 s і 6 р-електронів), на третьому — 1 s-електрон (який номер рівня, стільки й форм орбіта лей). Отже, Натрій — s-елемент, в його атомі починає формуватися 3-й рівень.<br> |
| | | | |
| | Атом Натрію має великий радіус, отже, притягання до ядра одного зовнішнього електрона невелике, і атом легко його втрачає, тому Натрій виявляє яскраво виражені металічні властивості, його валентність дорівнює 1.<br> | | Атом Натрію має великий радіус, отже, притягання до ядра одного зовнішнього електрона невелике, і атом легко його втрачає, тому Натрій виявляє яскраво виражені металічні властивості, його валентність дорівнює 1.<br> |
| Строка 19: |
Строка 15: |
| | У такий спосіб можна схарактеризувати будь-який елемент. При цьому варто дотримуватися такої послідовності: місце в періодичній системі → склад → будова → властивості.<br> | | У такий спосіб можна схарактеризувати будь-який елемент. При цьому варто дотримуватися такої послідовності: місце в періодичній системі → склад → будова → властивості.<br> |
| | | | |
| - | Розглянь ще один приклад — Хлор СІ і зверни увагу, що ті самі відомості можна подати у дещо скороченому вигляді, якщо обґрунтування зрозуміле і ти можеш навести його усно.<br><br>1. Місце в періодичній системі: 3-й період, 7А група, протонне число— 17, A<sub>r</sub>(СІ)= 35,5.<br>2. Склад атома: Сl = 17р<sup>+</sup>,<br>35 - 17 = 18n<sup>0</sup>, 17<sup>ê</sup>.<br>3. Будова атома: ls<sup>2</sup>2s<sup>2</sup>2p<sup>6</sup>3s<sup>2</sup>3p<sup>5</sup>.<br>4. Властивості: Хлор міститься наприкінці 3-го періоду, в його атомі добудовується 3-й період. Радіус атома невеликий, отже, притягання 7-ми зовнішніх (3s<sup>2</sup>3p<sup>5</sup>) електронів збільшується, і атом легко приєднує на свою електронну оболонку один електрон, якого не вистачає до завершення зовнішнього рівня. Тому Хлор виявляє високу електронегативність. Він має яскраво виражені неметалічні властивості.<br>Проста речовина, утворена атомами Хлору — газуватий хлор Сl<sub>2</sub> — типовий неметал. Найвищий оксид Сl<sub>2</sub>O<sub>7</sub>, йому відповідає гідрат оксиду НСlO<sub>4</sub> — хлорна кислота.<br><br><br><u>ВИСНОВКИ</u><br>Незважаючи на те, що в наш час відомо багато варіантів зображення періодичної системи хімічних елементів, їх суть від цього не змінюється: елементи в періодичній системі утворюють послідовність, що відповідає зарядам ядер їх атомів.<br>Порядковий номер елемента в періодичній системі (протонне число) дорівнює заряду ядра і показує кількість електронів у атомі.<br>Номер періоду в періодичній системі показує число енергетичних рівнів у електронній оболонці атомів елементів, а номер енергетичного рівня — кількість форм орбіталей. Номер А групи в періодичній системі показує число електронів на зовнішньому енергетичному рівні.<br><br><br><u>Завдання для самоконтролю</u><br>1. Знаючи місце Алюмінію в періодичній системі, схарактеризуй цей елемент.<br>2. В якого елемента сильніше виявлені металічні властивості: а) у Літію чи Берилію; б) у Берилію чи Магнію? Відповідь поясни.<br> | + | Розглянь ще один приклад — Хлор СІ і зверни увагу, що ті самі відомості можна подати у дещо скороченому вигляді, якщо обґрунтування зрозуміле і ти можеш навести його усно.<br><br>1. Місце в періодичній системі: 3-й період, 7А група, протонне число— 17, A<sub>r</sub>(СІ)= 35,5.<br>2. Склад атома: Сl = 17р<sup>+</sup>,<br>35 - 17 = 18n<sup>0</sup>, 17<sup>ê</sup>.<br>3. Будова атома: ls<sup>2</sup>2s<sup>2</sup>2p<sup>6</sup>3s<sup>2</sup>3p<sup>5</sup>.<br>4. Властивості: Хлор міститься наприкінці 3-го періоду, в його атомі добудовується 3-й період. Радіус атома невеликий, отже, притягання 7-ми зовнішніх (3s<sup>2</sup>3p<sup>5</sup>) електронів збільшується, і атом легко приєднує на свою електронну оболонку один електрон, якого не вистачає до завершення зовнішнього рівня. Тому Хлор виявляє високу електронегативність. Він має яскраво виражені неметалічні властивості.<br>Проста речовина, утворена атомами Хлору — газуватий хлор Сl<sub>2</sub> — типовий неметал. Найвищий оксид Сl<sub>2</sub>O<sub>7</sub>, йому відповідає гідрат оксиду НСlO<sub>4</sub> — хлорна кислота.<br><br><br>'''ВИСНОВКИ'''<br>Незважаючи на те, що в наш час відомо багато варіантів зображення періодичної системи хімічних елементів, їх суть від цього не змінюється: елементи в періодичній системі утворюють послідовність, що відповідає зарядам ядер їх атомів.<br>Порядковий номер елемента в періодичній системі (протонне число) дорівнює заряду ядра і показує кількість електронів у атомі.<br>Номер періоду в періодичній системі показує число енергетичних рівнів у електронній оболонці атомів елементів, а номер енергетичного рівня — кількість форм орбіталей. Номер А групи в періодичній системі показує число електронів на зовнішньому енергетичному рівні.<br><br><br>'''Завдання для самоконтролю'''<br>''1. Знаючи місце Алюмінію в періодичній системі, схарактеризуй цей елемент.<br>2. В якого елемента сильніше виявлені металічні властивості: а) у Літію чи Берилію; б) у Берилію чи Магнію? Відповідь поясни.<br>'' |
| | | | |
| - | 3. В якого елемента сильніше виявлені неметалічні властивості: а) у Сульфуру чи Фосфору; б) у Сульфуру чи Селену? Відповідь поясни.<br> | + | ''3. В якого елемента сильніше виявлені неметалічні властивості: а) у Сульфуру чи Фосфору; б) у Сульфуру чи Селену? Відповідь поясни.<br>'' |
| | | | |
| - | 4. За розподілом електронів по енергетичних рівнях в атомі хімічного елемента — 2, 8, 2 електронів, визнач: а) місце елемента в періодичній системі; б) властивості простої речовини; в) склад і властивості вищого оксиду й відповідного йому гідроксиду; г) склад леткої гідрогенної сполуки, якщо даний елемент її утворює.<br> | + | ''4. За розподілом електронів по енергетичних рівнях в атомі хімічного елемента — 2, 8, 2 електронів, визнач: а) місце елемента в періодичній системі; б) властивості простої речовини; в) склад і властивості вищого оксиду й відповідного йому гідроксиду; г) склад леткої гідрогенної сполуки, якщо даний елемент її утворює.<br>'' |
| | | | |
| - | 5. Зазнач відповідність оксиду його характеру:<br>1) кислотний; a) Na<sub>2</sub>O;<br>2) основний; (б) Р<sub>2</sub>O<sub>5</sub>;<br>3) амфотерний. (в) SiO<sub>2</sub>;<br> (г) ZnO.<br> | + | ''5. Зазнач відповідність оксиду його характеру:<br>1) кислотний; a) Na<sub>2</sub>O;<br>2) основний; (б) Р<sub>2</sub>O<sub>5</sub>;<br>3) амфотерний. (в) SiO<sub>2</sub>;<br> (г) ZnO.<br>'' |
| | | | |
| - | 6. Періодично змінюються в періодичній системі<br>(а) величина заряду ядра атома;<br>(б) відносна атомна маса елемента;<br>(в) кількість енергетичних рівнів у електронній оболонці атома;<br>(г) кількість електронів на зовнішньому енергетичному рівні.<br> | + | ''6. Періодично змінюються в періодичній системі<br>(а) величина заряду ядра атома;<br>(б) відносна атомна маса елемента;<br>(в) кількість енергетичних рівнів у електронній оболонці атома;<br>(г) кількість електронів на зовнішньому енергетичному рівні.<br>'' |
| | | | |
| - | 7. У межах періоду збільшення протонного числа елемента супроводжується<br>(а) збільшенням атомного радіуса і зменшенням електронегативності;<br>(б) збільшенням атомного радіуса і збільшенням електронегативності;<br>(в) зменшенням атомного радіуса і зменшенням електронегативності;<br>(г) зменшенням атомного радіуса і збільшенням електронегативності.<br> | + | ''7. У межах періоду збільшення протонного числа елемента супроводжується<br>(а) збільшенням атомного радіуса і зменшенням електронегативності;<br>(б) збільшенням атомного радіуса і збільшенням електронегативності;<br>(в) зменшенням атомного радіуса і зменшенням електронегативності;<br>(г) зменшенням атомного радіуса і збільшенням електронегативності.<br>'' |
| | | | |
| - | 8. Знаючи протонні числа хімічних елементів № 30, № 11, № 18, визнач, чи будуть їх вищі оксиди взаємодіяти з кислотою, і напиши рівняння можливих реакцій.<br> | + | ''8. Знаючи протонні числа хімічних елементів № 30, № 11, № 18, визнач, чи будуть їх вищі оксиди взаємодіяти з кислотою, і напиши рівняння можливих реакцій.''<br> |
| | | | |
| - | <br><u>Додаткові завдання</u><br>9*. Формула вищого гідроксиду елемента зі скороченою електронною конфігурацією ...3s<sup>2</sup>3p<sup>4</sup><br>(а) Е(ОН)<sub>2</sub>; (б) НЕO<sub>4</sub>; (в) Н<sub>2</sub>ЕO<sub>4</sub>; (г) Е(ОН)<sub>3</sub>. <br> | + | <br>'''Додаткові завдання'''<br>''9*. Формула вищого гідроксиду елемента зі скороченою електронною конфігурацією ...3s<sup>2</sup>3p<sup>4</sup><br>(а) Е(ОН)<sub>2</sub>; (б) НЕO<sub>4</sub>; (в) Н<sub>2</sub>ЕO<sub>4</sub>; (г) Е(ОН)<sub>3</sub>. <br>'' |
| | | | |
| - | 10*. Елемент зі скороченою електронною конфігурацією ...3s<sup>2</sup>3p<sup>3</sup><br>(а) неметал;<br>(б) перебуває у 3-му періоді;<br>(в) має п'ять зовнішніх (валентних) електронів;<br>(г) перебуває у ЗА групі.<br> | + | ''10*. Елемент зі скороченою електронною конфігурацією ...3s<sup>2</sup>3p<sup>3</sup><br>(а) неметал;<br>(б) перебуває у 3-му періоді;<br>(в) має п'ять зовнішніх (валентних) електронів;<br>(г) перебуває у ЗА групі.<br>'' |
| | | | |
| - | 11*. Скорочені електронні конфігурації атомів елементів 7А групи<br>(а) ...3s<sup>2</sup>3p<sup>5</sup>;<br>(б) ...3s<sup>2</sup>Зр<sup>6</sup>Зd<sup>3</sup>4s<sup>2</sup>; <br>(в)...2s<sup>2</sup>2p<sup>3</sup>; <br> | + | ''11*. Скорочені електронні конфігурації атомів елементів 7А групи<br>(а) ...3s<sup>2</sup>3p<sup>5</sup>;<br>(б) ...3s<sup>2</sup>Зр<sup>6</sup>Зd<sup>3</sup>4s<sup>2</sup>; <br>(в)...2s<sup>2</sup>2p<sup>3</sup>; <br>'' |
| | | | |
| - | (г)...3s<sup>2</sup>3p<sup>6</sup>3d<sup>10</sup>4s<sup>2</sup>4p<sup>5</sup>.<br> | + | ''(г)...3s<sup>2</sup>3p<sup>6</sup>3d<sup>10</sup>4s<sup>2</sup>4p<sup>5</sup>.<br>'' |
| | | | |
| - | 12*. Конфігурація зовнішнього електронного шару елемента 4s<sup>1</sup>. Склади повну електронну формулу атома цього елемента. Зазнач період і групу періодичної системи, де він розміщений, а також склад ядра його атома і назви елемент. | + | ''12*. Конфігурація зовнішнього електронного шару елемента 4s<sup>1</sup>. Склади повну електронну формулу атома цього елемента. Зазнач період і групу періодичної системи, де він розміщений, а також склад ядра його атома і назви елемент.'' |
| | | | |
| - | 13*. За розподілом електронів по енергетичних комірках зовнішнього рівня визнач елемент з найбільш сильно вираженими властивостями 1) металічними: 2) неметалічними:<br>[[Image:Енергетичні комірки 1.jpg]]<br> | + | ''13*. За розподілом електронів по енергетичних комірках зовнішнього рівня визнач елемент з найбільш сильно вираженими властивостями 1) металічними: 2) неметалічними:''<br>[[Image:Енергетичні комірки 1.jpg|завдання. фото]]<br> |
| | | | |
| - | 14*. Найбільш сильно виражені металічні властивості в елемента, скорочена електронна конфігурація якого<br>(а) 1s<sup>2</sup>2s<sup>2</sup>; (в) ...3d<sup>3</sup>4s<sup>2</sup>;<br>(б) ...3s<sup>2</sup>3p<sup>3</sup>; (г)...3s<sup>2</sup>3p<sup>6</sup>4s<sup>1</sup>. | + | ''14*. Найбільш сильно виражені металічні властивості в елемента, скорочена електронна конфігурація якого<br>(а) 1s<sup>2</sup>2s<sup>2</sup>; (в) ...3d<sup>3</sup>4s<sup>2</sup>;<br>(б) ...3s<sup>2</sup>3p<sup>3</sup>; (г)...3s<sup>2</sup>3p<sup>6</sup>4s<sup>1</sup>.'' |
| | | | |
| - | 15*. Елементи, що розміщені в одній і тій самій групі А, — це<br>(а) ...2s<sup>1</sup>; (в) ...3d<sup>3</sup>4s<sup>2</sup>;<br>(б) ...3s<sup>2</sup>3p<sup>3</sup>; (г) ...4s<sup>2</sup>4p<sup>3</sup>.<br> | + | ''15*. Елементи, що розміщені в одній і тій самій групі А, — це<br>(а) ...2s<sup>1</sup>; (в) ...3d<sup>3</sup>4s<sup>2</sup>;<br>(б) ...3s<sup>2</sup>3p<sup>3</sup>; (г) ...4s<sup>2</sup>4p<sup>3</sup>.''<br> |
| | | | |
| | <br> | | <br> |
| | | | |
| - | ----
| + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту'' |
| - | | + | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту | + | |
| | | | |
| | <br> <sub>Планування уроків [[Хімія|хімії]], книги та [[Гіпер|підручники]] по всім предметам, учням та вчителям на допомогу </sub> <br> | | <br> <sub>Планування уроків [[Хімія|хімії]], книги та [[Гіпер|підручники]] по всім предметам, учням та вчителям на допомогу </sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> | | <br> |
Текущая версия на 06:17, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Характеристика хiмічних елементів малих періодів за їх місцем у періодичній системі та будовою атома
Існує понад 500 різних видів зображення періодичної системи — у вигляді таблиць, графіків, схем тощо. Найпоширенішими є табличні варіанти. Один із них ти вже знаєш. Це — короткоперіодний варіант, або коротка форма періодичної системи. Використовується ще довгоперіодний варіант, або довга форма періодичної системи. Він також був розроблений Д. І. Менделєєвим.
Нині у світі великого поширення набула довга форма. Вона дедалі стає популярнішою, оскільки краще узгоджується з будовою атомів хімічних елементів. Але за своєю суттю і коротка, і довга форми періодичної системи в цілому ідентичні (тотожні, рівнозначні). Вони доповнюють одна одну. Але в їх структурі є деякі відмінності.
У довгій формі періоди займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи (позначені рожевим кольором), в атомах яких заповнюються s-орбіталі (порівняй з короткою формою періодичної системи). Праворуч розміщуються р-елементи (позначені жовтим кольором). У s- і р-елементів забудовується зовнішній енергетичний рівень.
У середній частині періодів розміщуються перехідні елементи (синій колір), в атомах яких заповнюються d-орбіталі передзовнішнього рівня.
Родини лантаноїдів та актиноїдів (зелений колір) — це f-елементи. В їх атомах заповнюється третій ззовні рівень. Як правило, ці родини виносять за межі таблиці, як у короткій, так і в довгій формах. Відмінність у послідовності заповнення енергетичних рівнів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів.
Періодична повторюваність будови зовнішніх енергетичних рівнів атомів є причиною періодичної зміни властивостей хімічних елементів. У цьому полягає фізична суть періодичного закону, яка не залежить від форми подання періодичної системи елементів.
Знаючи місце елемента в періодичній системі, можна судити про будову його атома, а відтак — і про властивості простої речовини, утвореної цим елементом, характер його оксиду й гідрату оксиду тощо.
• Користуючись довгою формою періодичної системи, схарактеризуй хімічний елемент Натрій. Що ти можеш сказати про нього на підставі того місця, яке він займає у періодичній системі?
Перевір себе. Ось що у тебе повинно вийти.
Натрій Na — хімічний елемент, розміщений у 3-му періоді, в 1А групі. Протонне число (порядковий номер) — 11. Відносна атомна маса Ar(Na) = 23.
Ядро атома Натрію містить 11 протонів, оскільки заряд ядра +11, і 23 - 11 = = 12 нейтронів. В атомі Натрію є 11 електронів, які розподіляються на 3-х енергетичних рівнях (згідно з номером періоду): на першому рівні 2 s-електрони, на другому — 8 (2 s і 6 р-електронів), на третьому — 1 s-електрон (який номер рівня, стільки й форм орбіта лей). Отже, Натрій — s-елемент, в його атомі починає формуватися 3-й рівень.
Атом Натрію має великий радіус, отже, притягання до ядра одного зовнішнього електрона невелике, і атом легко його втрачає, тому Натрій виявляє яскраво виражені металічні властивості, його валентність дорівнює 1.
Проста речовина, утворена атомами Натрію як хімічного елемента, натрій — це типовий метал. Хімічний елемент Натрій утворює основний оксид Na20, якому відповідає гідроксид NaOH — типова основа, луг.
У такий спосіб можна схарактеризувати будь-який елемент. При цьому варто дотримуватися такої послідовності: місце в періодичній системі → склад → будова → властивості.
Розглянь ще один приклад — Хлор СІ і зверни увагу, що ті самі відомості можна подати у дещо скороченому вигляді, якщо обґрунтування зрозуміле і ти можеш навести його усно.
1. Місце в періодичній системі: 3-й період, 7А група, протонне число— 17, Ar(СІ)= 35,5.
2. Склад атома: Сl = 17р+,
35 - 17 = 18n0, 17ê.
3. Будова атома: ls22s22p63s23p5.
4. Властивості: Хлор міститься наприкінці 3-го періоду, в його атомі добудовується 3-й період. Радіус атома невеликий, отже, притягання 7-ми зовнішніх (3s23p5) електронів збільшується, і атом легко приєднує на свою електронну оболонку один електрон, якого не вистачає до завершення зовнішнього рівня. Тому Хлор виявляє високу електронегативність. Він має яскраво виражені неметалічні властивості.
Проста речовина, утворена атомами Хлору — газуватий хлор Сl2 — типовий неметал. Найвищий оксид Сl2O7, йому відповідає гідрат оксиду НСlO4 — хлорна кислота.
ВИСНОВКИ
Незважаючи на те, що в наш час відомо багато варіантів зображення періодичної системи хімічних елементів, їх суть від цього не змінюється: елементи в періодичній системі утворюють послідовність, що відповідає зарядам ядер їх атомів.
Порядковий номер елемента в періодичній системі (протонне число) дорівнює заряду ядра і показує кількість електронів у атомі.
Номер періоду в періодичній системі показує число енергетичних рівнів у електронній оболонці атомів елементів, а номер енергетичного рівня — кількість форм орбіталей. Номер А групи в періодичній системі показує число електронів на зовнішньому енергетичному рівні.
Завдання для самоконтролю
1. Знаючи місце Алюмінію в періодичній системі, схарактеризуй цей елемент.
2. В якого елемента сильніше виявлені металічні властивості: а) у Літію чи Берилію; б) у Берилію чи Магнію? Відповідь поясни.
3. В якого елемента сильніше виявлені неметалічні властивості: а) у Сульфуру чи Фосфору; б) у Сульфуру чи Селену? Відповідь поясни.
4. За розподілом електронів по енергетичних рівнях в атомі хімічного елемента — 2, 8, 2 електронів, визнач: а) місце елемента в періодичній системі; б) властивості простої речовини; в) склад і властивості вищого оксиду й відповідного йому гідроксиду; г) склад леткої гідрогенної сполуки, якщо даний елемент її утворює.
5. Зазнач відповідність оксиду його характеру:
1) кислотний; a) Na2O;
2) основний; (б) Р2O5;
3) амфотерний. (в) SiO2;
(г) ZnO.
6. Періодично змінюються в періодичній системі
(а) величина заряду ядра атома;
(б) відносна атомна маса елемента;
(в) кількість енергетичних рівнів у електронній оболонці атома;
(г) кількість електронів на зовнішньому енергетичному рівні.
7. У межах періоду збільшення протонного числа елемента супроводжується
(а) збільшенням атомного радіуса і зменшенням електронегативності;
(б) збільшенням атомного радіуса і збільшенням електронегативності;
(в) зменшенням атомного радіуса і зменшенням електронегативності;
(г) зменшенням атомного радіуса і збільшенням електронегативності.
8. Знаючи протонні числа хімічних елементів № 30, № 11, № 18, визнач, чи будуть їх вищі оксиди взаємодіяти з кислотою, і напиши рівняння можливих реакцій.
Додаткові завдання
9*. Формула вищого гідроксиду елемента зі скороченою електронною конфігурацією ...3s23p4
(а) Е(ОН)2; (б) НЕO4; (в) Н2ЕO4; (г) Е(ОН)3.
10*. Елемент зі скороченою електронною конфігурацією ...3s23p3
(а) неметал;
(б) перебуває у 3-му періоді;
(в) має п'ять зовнішніх (валентних) електронів;
(г) перебуває у ЗА групі.
11*. Скорочені електронні конфігурації атомів елементів 7А групи
(а) ...3s23p5;
(б) ...3s2Зр6Зd34s2;
(в)...2s22p3;
(г)...3s23p63d104s24p5.
12*. Конфігурація зовнішнього електронного шару елемента 4s1. Склади повну електронну формулу атома цього елемента. Зазнач період і групу періодичної системи, де він розміщений, а також склад ядра його атома і назви елемент.
13*. За розподілом електронів по енергетичних комірках зовнішнього рівня визнач елемент з найбільш сильно вираженими властивостями 1) металічними: 2) неметалічними:
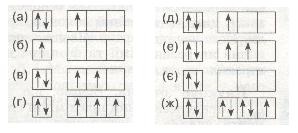
14*. Найбільш сильно виражені металічні властивості в елемента, скорочена електронна конфігурація якого
(а) 1s22s2; (в) ...3d34s2;
(б) ...3s23p3; (г)...3s23p64s1.
15*. Елементи, що розміщені в одній і тій самій групі А, — це
(а) ...2s1; (в) ...3d34s2;
(б) ...3s23p3; (г) ...4s24p3.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Планування уроків хімії, книги та підручники по всім предметам, учням та вчителям на допомогу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












