|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Ковалентний зв’язок, його види — полярний і неполярний. Утворення ковалентного неполярного зв’язку. Утворення ковалентного полярного зв’язку''' <metakeywords>Хімія, клас, урок, на Тему, Ковалентний зв’язок, його види, полярний і неполярний, Утворення ковалентного, неполярного зв’язку, полярного зв’язку</metakeywords> <br><br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Ковалентний зв’язок, його види — полярний і неполярний. Утворення ковалентного неполярного зв’язку. Утворення ковалентного полярного зв’язку''' <metakeywords>Хімія, клас, урок, на Тему, Ковалентний зв’язок, його види, полярний і неполярний, Утворення ковалентного, неполярного зв’язку, полярного зв’язку</metakeywords> <br><br> |
| | | | |
| - | '''Суть [[Хімічний_зв’язок_і_будова_речовин|хімічного зв'язку]].''' [[Атоми_і_хімічні_елементи._Перевір_себе|Атоми]] різних елементів, що входять до складу простих чи [[Ілюстрації_до_уроку_«Прості_і_складні_речовини._Поняття_про_неорганічні_та_органічні_речовини.»|складних речовин]], утримуються разом завдяки наявності хімічного зв'язку. В його утворенні беруть участь кулонівські сили, носіями яких є електрони і ядра атомів. | + | '''Суть [[Хімічний зв’язок і будова речовин|хімічного зв'язку]].''' [[Атоми і хімічні елементи. Перевір себе|Атоми]] різних елементів, що входять до складу простих чи [[Ілюстрації до уроку «Прості і складні речовини. Поняття про неорганічні та органічні речовини.»|складних речовин]], утримуються разом завдяки наявності хімічного зв'язку. В його утворенні беруть участь кулонівські сили, носіями яких є електрони і ядра атомів. |
| | | | |
| | Хімічний зв'язок виникає внаслідок взаємодії позитивно заряджених ядер і негативно заряджених електронів. | | Хімічний зв'язок виникає внаслідок взаємодії позитивно заряджених ядер і негативно заряджених електронів. |
| | | | |
| - | Уяви собі, що два атоми Гідрогену перебувають на дуже великій відстані один від одного. Вони не взаємодіють між собою. У разі їх зближення починають діяти сили притягання між ядром одного атома та електроном іншого, а також сили відштовхування між [[Атомное_ядро|ядрами]] і між електронами обох атомів. На деякій відстані сили притягання переважають сили відштовхування. При дальшому зближенні атомів, навпаки, сили відштовхування починають переважати сили притягання. Тому потенціальна енергія системи у разі зближення атомів Гідрогену спочатку знижується, а потім підвищується. Якщо ж сили притягання дорівнюють силам відштовхування, то енергія системи в цьому випадку найменша. Такий стан системи найстійкіший, він відповідає утворенню молекули Н<sub>2</sub>. Отже, хімічний зв'язок — це взаємодія атомів або будь- яких інших частинок у речовині, яка зумовлює їхнє сполучення в молекули чи кристали.<br>Така взаємодія спричинює зменшення енергії утвореної молекули (кристала) порівняно з енергією поодиноких атомів, що взаємодіють.<br>Існує кілька типів хімічного зв'язку: ковалентний, йонний, металічний та ін.<br><br><br>'''[[Тема_23._Електронна_природа_хiмічного_зв’язку._Електронегативність_елементів._Ковалентний_зв’язок._Електронні_формули_молекул_речовин|Ковалентний неполярний зв'язок]].'''<br>Для прикладу розглянемо утворення молекули водню Н<sub>2</sub>. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.<br> | + | Уяви собі, що два атоми Гідрогену перебувають на дуже великій відстані один від одного. Вони не взаємодіють між собою. У разі їх зближення починають діяти сили притягання між ядром одного атома та електроном іншого, а також сили відштовхування між [[Атомное ядро|ядрами]] і між електронами обох атомів. На деякій відстані сили притягання переважають сили відштовхування. При дальшому зближенні атомів, навпаки, сили відштовхування починають переважати сили притягання. Тому потенціальна енергія системи у разі зближення атомів Гідрогену спочатку знижується, а потім підвищується. Якщо ж сили притягання дорівнюють силам відштовхування, то енергія системи в цьому випадку найменша. Такий стан системи найстійкіший, він відповідає утворенню молекули Н<sub>2</sub>. Отже, хімічний зв'язок — це взаємодія атомів або будь- яких інших частинок у речовині, яка зумовлює їхнє сполучення в молекули чи кристали.<br>Така взаємодія спричинює зменшення енергії утвореної молекули (кристала) порівняно з енергією поодиноких атомів, що взаємодіють.<br>Існує кілька типів хімічного зв'язку: ковалентний, йонний, металічний та ін.<br><br><br>'''[[Тема 23. Електронна природа хiмічного зв’язку. Електронегативність елементів. Ковалентний зв’язок. Електронні формули молекул речовин|Ковалентний неполярний зв'язок]].'''<br>Для прикладу розглянемо утворення молекули водню Н<sub>2</sub>. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.<br> |
| | | | |
| | <br>Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:<br> | | <br>Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:<br> |
| Строка 11: |
Строка 11: |
| | [[Image:Атоми Гідрогену в молекулі водню.jpg|Схема утворення хімічного зв'язку між атомами. фото]]<br> | | [[Image:Атоми Гідрогену в молекулі водню.jpg|Схема утворення хімічного зв'язку між атомами. фото]]<br> |
| | | | |
| - | [[Image:Підвищена електронна густина.jpg|Схема утворення хімічного зв'язку між атомами. фото]] | + | [[Image:Підвищена електронна густина.jpg|Схема утворення хімічного зв'язку між атомами. фото]] |
| | | | |
| | ''Мал. 23. Схема утворення хімічного зв'язку між атомами.''<br>Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.<br>Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F<sub>2</sub>. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:<br> | | ''Мал. 23. Схема утворення хімічного зв'язку між атомами.''<br>Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.<br>Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F<sub>2</sub>. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:<br> |
| | | | |
| - | [[Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg|Структурна формула водню. фото]] | + | [[Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg|Структурна формула водню. фото]] |
| | | | |
| | ''Мал. 24. Структурна формула водню.''<br>У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:<br> | | ''Мал. 24. Структурна формула водню.''<br>У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:<br> |
| Строка 23: |
Строка 23: |
| | [[Image:Спільна ел. пара -2.jpg|Електронна пара. фото]] | | [[Image:Спільна ел. пара -2.jpg|Електронна пара. фото]] |
| | | | |
| - | ''Мал. 25. Електронна пара.'' | + | ''Мал. 25. Електронна пара.'' |
| | | | |
| - | У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.<br>Хімічний зв'язок, який утворюється за допомогою спільних електронних пар, називають ковалентним зв'язком.<br>Слово «ковалентний» означає «спільновалентний»: атоми разом володіють усуспільненими валентними електронами.<br>У розглянутих випадках спільна електронна пара належить обом атомам однаковою мірою. Такий ковалентний зв'язок називають неполярним. Він виникає під час взаємодії атомів неметалів одного й того самого хімічного елемента, оскільки в них однакова електронегативність. Так, у молекулах Н<sub>2</sub>, О<sub>2</sub>, F<sub>2</sub>, Сl<sub>2</sub> існує неполярний ковалентний зв'язок. | + | У наведеному прикладі зовнішній [[Енергетичний_обмін_та_його_етапи._Повні_уроки|енергетичний рівень]] завершується до октету — восьми електронів.<br>Хімічний зв'язок, який утворюється за допомогою спільних електронних пар, називають ковалентним зв'язком.<br>Слово «ковалентний» означає «спільновалентний»: атоми разом володіють усуспільненими валентними електронами.<br>У розглянутих випадках спільна електронна пара належить обом атомам однаковою мірою. Такий ковалентний зв'язок називають неполярним. Він виникає під час взаємодії атомів неметалів одного й того самого хімічного елемента, оскільки в них однакова електронегативність. Так, у молекулах Н<sub>2</sub>, О<sub>2</sub>, F<sub>2</sub>, Сl<sub>2</sub> існує неполярний ковалентний зв'язок. |
| | | | |
| - | <br>'''Кратність ковалентного зв'язку.''' Бувають випадки, коли два атоми усуспільнюють кілька пар валентних електронів. У такому разі говорять про кратність ковалентного зв'язку. Якщо між атомами виникла одна спільна електронна пара, то такий ковалентний зв'язок називають одинарним, якщо дві — подвійним, якщо три — потрійним. Розглянь, наприклад, схему утворення потрійного ковалентного зв'язку в молекулі азоту N<sub>2</sub>:<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N.jpg]]<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N - 2.jpg]]<br>'''Ковалентний полярний зв'язок.''' Якщо атоми, що взаємодіють, мають різну електронегативність (атоми різних неметалів), то спільна електронна пара зміщується до атома з більшою електроне-гативністю. У цьому разі виникає полярний ковалентний зв'язок. Наприклад, у молекулі флуороводню HF зв'язок ковалентний полярний:<br> | + | <br>'''Кратність [[Тема_23._Електронна_природа_хiмічного_зв’язку._Електронегативність_елементів._Ковалентний_зв’язок._Електронні_формули_молекул_речовин|ковалентного зв'язку]].''' Бувають випадки, коли два атоми усуспільнюють кілька пар валентних електронів. У такому разі говорять про кратність ковалентного зв'язку. Якщо між атомами виникла одна спільна електронна пара, то такий ковалентний зв'язок називають одинарним, якщо дві — подвійним, якщо три — потрійним. Розглянь, наприклад, схему утворення потрійного ковалентного зв'язку в молекулі азоту N<sub>2</sub>:<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N.jpg|Схема утворення потрійного ковалентного зв'язку. фото]]<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N - 2.jpg|Схема утворення потрійного ковалентного зв'язку. фото]] |
| | | | |
| - | [[Image:Ковалентний полярний зв'язок у молекулі флуороводню HF.jpg]] | + | ''Мал. 26. Схема утворення потрійного ковалентного зв'язку.''<br>'''Ковалентний полярний зв'язок.''' Якщо атоми, що взаємодіють, мають різну [[57._Поняття_про_електронегативність_елементів|електронегативність]] (атоми різних неметалів), то спільна електронна пара зміщується до атома з більшою електроне-гативністю. У цьому разі виникає полярний ковалентний зв'язок. Наприклад, у молекулі флуороводню HF зв'язок ковалентний полярний:<br> |
| | | | |
| - | [[Image:Молекула флуороводню HF- 2 .jpg]]<br>У результаті зміщення електронної пари в молекулі HF (стрілка показує напрямок зміщення) молекула стає полярною, виникає диполь.<br>'''''Диполь''''' — це система з двох зарядів, однакових за величиною і протилежних за знаком.<br>Вважають, що атом, до якого зміщена електронна пара, набуває деякого негативного заряду, а атом, від якого зміщена електронна пара, — деякого позитивного заряду:<br> | + | [[Image:Ковалентний полярний зв'язок у молекулі флуороводню HF.jpg|Полярний ковалентний зв'язок. фото]] |
| | | | |
| - | [[Image:Зміщена електронна пара.jpg]]<br>(гр. літера δ (дельта) позначає частковий заряд, тобто менший за одиничний).<br> | + | [[Image:Молекула флуороводню HF- 2 .jpg|Полярний ковалентний зв'язок. фото]] |
| | | | |
| - | <br>Полярний ковалентний зв'язок незавжди зумовлює утворення диполя. Наприклад, у разі формування молекули карбон(ІV) оксиду С0<sub>2</sub> електронні пари зміщуються до Оксигену як до більш електронегативного елемента. Але диполь не виникає, бо молекула симетрична, вона має лінійну будову:<br>
| + | ''Мал. 27. Полярний ковалентний зв'язок.''<br>У результаті зміщення електронної пари в молекулі HF (стрілка показує напрямок зміщення) молекула стає полярною, виникає диполь.<br>'''''Диполь''''' — це система з двох [[Ілюстрації_до_теми_«Дискретність_електричного_заряду»|зарядів]], однакових за величиною і протилежних за знаком.<br>Вважають, що атом, до якого зміщена електронна пара, набуває деякого негативного заряду, а атом, від якого зміщена електронна пара, — деякого позитивного заряду:<br> |
| | | | |
| - | [[Image:Формування молекули карбон(ІV) оксиду С02 .jpg]]<br>Молекули води Н<sub>2</sub>О, навпаки, мають кутову будову. Полярні зв'язки О—Н розміщені під кутом 104,5°, що спричинює несиметричність структури і полярність молекул води:<br> | + | [[Image:Зміщена електронна пара.jpg|формула. фото]]<br>(гр. літера δ (дельта) позначає частковий заряд, тобто менший за одиничний).<br> |
| | | | |
| - | [[Image:Полярність молекул води.jpg]]<br>
| + | <br>Полярний ковалентний зв'язок незавжди зумовлює утворення диполя. Наприклад, у разі формування молекули карбон(ІV) оксиду С0<sub>2</sub> електронні пари зміщуються до Оксигену як до більш електронегативного елемента. Але диполь не виникає, бо молекула симетрична. |
| | | | |
| - | Кутові молекули сірководню H<sub>2</sub>S, пірамідальні молекули амоніаку NH<sub>3</sub> також мають несиметричну структуру, тому вони полярні (мал. 15).<br>[[Image:Мал. 15. Полярні молекули води та амоніаку.jpg]]<br>Мал. 15. Полярні молекули води та амоніаку<br><br>Бувають випадки, коли кількість хімічних зв'язків, утворених атомом у сполуці, більша за кількість неспарених електронів на зовнішньому енергетичному рівні атома. Так, у атомі Карбону на зовнішньому рівні всього два неспарені електрони, але номер групи, в якій він розміщений, засвідчує, що в атомі має бути 4 валентні електрони. Звідки ж беруться ще два неспарені електрони?<br>Згадаємо електронну формулу Карбону:<br><sub>6</sub>С 1s<sup>2</sup>2s<sup>2</sup>2p<sup>2</sup><br><br> | + | Молекули [[Вода_-_найпоширеніша_речовина_на_Землі._Повні_уроки|води]] Н<sub>2</sub>О, навпаки, мають кутову будову. Полярні зв'язки О—Н розміщені під кутом 104,5°, що спричинює несиметричність структури і полярність молекул води:<br> |
| | + | |
| | + | [[Image:Полярність молекул води.jpg|Полярність молекул води. фото]]<br> |
| | + | |
| | + | Кутові молекули сірководню H<sub>2</sub>S, пірамідальні молекули амоніаку NH<sub>3</sub> також мають несиметричну структуру, тому вони полярні (мал. 28).<br>[[Image:Мал. 15. Полярні молекули води та амоніаку.jpg|Полярні молекули води та амоніаку. фото]]<br>''Мал. 28. Полярні молекули води та амоніаку''<br><br>Бувають випадки, коли кількість хімічних зв'язків, утворених атомом у сполуці, більша за кількість неспарених [[Будова_атома._Електрон._Йон._Повні_уроки|електронів]] на зовнішньому енергетичному рівні атома. Так, у атомі Карбону на зовнішньому рівні всього два неспарені електрони, але номер групи, в якій він розміщений, засвідчує, що в атомі має бути 4 валентні електрони. Звідки ж беруться ще два неспарені електрони?<br>Згадаємо електронну формулу Карбону:<br><sub>6</sub>С 1s<sup>2</sup>2s<sup>2</sup>2p<sup>2</sup><br><br> |
| | | | |
| | Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:<br> | | Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:<br> |
| | | | |
| - | [[Image:Розпаровування електронної пари атом Карбону.jpg]]<br>Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами, наприклад:<br> | + | [[Image:Розпаровування електронної пари атом Карбону.jpg|Розпарювання електронної пари. фото]] |
| | | | |
| - | [[Image:4 ковалентні зв'язки Карбону з іншими атомами .jpg]]<br>За кількістю утворених ковалентних зв'язків визначають валентність елемента. '''''Валентність''''' (від лат. valentia — сила) — це здатність атома приєднувати певне число інших атомів. Ця здатність залежить від кількості неспарених електронів атома в основному або збудженому стані, що беруть участь в утворенні спільних електронних пар з електронами інших атомів. Величина валентності визначається, як правило, числом ковалентних зв'язків, які даний атом утворює з іншими атомами. Саме тому валентність не має знака — ні плюс, ні мінус. Якщо атом Гідрогену утворює один ковалентний зв'язок, то він одновалентний, якщо атом Карбону утворює чотири зв'язки, то він — чотиривалентний.<br><br><br><u>ВИСНОВКИ</u><br>Хімічний зв'язок — це сила, яка утримує атоми (будь-які частинки) в хімічній сполуці. Вона виникає внаслідок взаємодії ядер і електронів. Хімічний зв'язок, що зумовлений утворенням спільних електронних пар, називається ковалентним. Він може бути полярним і неполярним залежно від того, які атоми з'єднуються: якщо однакові — неполярний, якщо різні за електронегативністю — полярний. Залежно від кількості спільних електронних пар, ковалентний зв'язок буває одинарним, подвійним, потрійним.<br>Спільні електронні пари утворюються внаслідок об'єднання неспаре-их валентних електронів атомів неметалів.<br>За кількістю неспарених електронів атома або кількістю утворених ковалентних зв'язків визначають валентність елемента. У результаті утворення хімічного зв'язку атоми набувають стійкого завершеного зовнішнього енергетичного рівня.<br><br><br><u>Завдання для самоконтролю</u><br>1. Як ти розумієш зміст поняття «хімічний зв'язок»? За рахунок чого він виникає?<br>2. Як утворюється ковалентний зв'язок? Які види ковалентного зв'язку ти знаєш? Чим вони подібні й чим відрізняються один від одного? Відповідь ілюструй прикладами.<br>3. В яких речовинах існує лише неполярний ковалентний зв'язок? Чому?<br>4. Чому молекули інертних газів, на відміну від усіх інших неметалів, у вільному стані одноатомні?<br>5. Напиши електронну і структурну формули гідроген пероксиду Н<sub>2</sub>О<sub>2</sub>. Обчисли, скільки електронів міститься на зовнішньому енергетичному рівні атома Оксигену, скільки хімічних зв'язків у цій молекулі. Визнач тип кожного хімічного зв'язку.<br>6. Намалюй схему перекривання: а) s-електронних хмар двох атомів; б) s-електронної хмари одного атома і р-електронної хмари іншого атома (за будь-якою з осей х, у, z).<br>7. Наведи електронну конфігурацію атома Оксигену і схему розподілу електронів за орбіталями зовнішнього енергетичного рівня атома. Зроби висновок, скільки електронів атома Оксигену можуть брати участь в утворенні ковалентних зв'язків з атомами Гідрогену?<br>8. Напиши електронні й структурні формули хлору СІ<sub>2</sub>, сірководню H<sub>2</sub>S, амоніаку NH<sub>3</sub>.<br>9. На підставі будови атомів Сульфуру й Гідрогену, поясни склад і будову молекули гідроген сульфіду H<sub>2</sub>S.<br><br><u>Додаткові завдання </u><br>10*. Неполярні молекули у речовини<br>(а) НСІ; (в) NH<sub>3</sub>;<br>(б) CF<sub>4</sub>; (г) H<sub>2</sub>S.<br>11*. Прикладом неполярної молекули, що містить полярний ковалентний зв'язок, є<br>(а) N<sub>2</sub>; (в) NH<sub>3</sub>;<br>(б) Н<sub>2</sub>О; (г) ССІ<sub>4</sub>.<br>12*. Під час утворення молекули НСІ перекриваються орбіталі типу (а) pip; (в) sis; б) sip; (r)ofip.<br>
| + | ''Мал. 29. Розпарювання електронної пари.''<br>Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами. |
| | | | |
| - | <br> | + | За кількістю утворених ковалентних зв'язків визначають валентність елемента. '''''[[Валентність_хімічних_елементів._Визначення_валентності_за_формулами_бінарних_сполук|Валентність]]''''' (від лат. valentia — сила) — це здатність атома приєднувати певне число інших атомів. Ця здатність залежить від кількості неспарених електронів атома в основному або збудженому стані, що беруть участь в утворенні спільних електронних пар з електронами інших атомів. Величина валентності визначається, як правило, числом ковалентних зв'язків, які даний атом утворює з іншими атомами. Саме тому валентність не має знака — ні плюс, ні мінус. Якщо атом Гідрогену утворює один ковалентний зв'язок, то він одновалентний, якщо атом Карбону утворює чотири зв'язки, то він — чотиривалентний.<br><br><br>'''ВИСНОВКИ'''<br>Хімічний зв'язок — це сила, яка утримує атоми (будь-які частинки) в хімічній сполуці. Вона виникає внаслідок взаємодії ядер і електронів. Хімічний зв'язок, що зумовлений утворенням спільних електронних пар, називається ковалентним. Він може бути полярним і неполярним залежно від того, які атоми з'єднуються: якщо однакові — неполярний, якщо різні за електронегативністю — полярний. Залежно від кількості спільних електронних пар, ковалентний зв'язок буває одинарним, подвійним, потрійним.<br>Спільні електронні пари утворюються внаслідок об'єднання неспаре-их валентних електронів атомів неметалів.<br>За кількістю неспарених електронів атома або кількістю утворених ковалентних зв'язків визначають валентність елемента. У результаті утворення хімічного зв'язку атоми набувають стійкого завершеного зовнішнього енергетичного рівня.<br><br><br>'''Завдання для самоконтролю'''<br>''1. Як ти розумієш зміст поняття «хімічний зв'язок»? За рахунок чого він виникає?<br>2. Як утворюється ковалентний зв'язок? Які види ковалентного зв'язку ти знаєш? Чим вони подібні й чим відрізняються один від одного? Відповідь ілюструй прикладами.<br>3. В яких речовинах існує лише неполярний ковалентний зв'язок? Чому?<br>4. Чому молекули інертних газів, на відміну від усіх інших неметалів, у вільному стані одноатомні?<br>5. Напиши електронну і структурну формули гідроген пероксиду Н<sub>2</sub>О<sub>2</sub>. Обчисли, скільки електронів міститься на зовнішньому енергетичному рівні атома Оксигену, скільки хімічних зв'язків у цій молекулі. Визнач тип кожного хімічного зв'язку.<br>6. Намалюй схему перекривання: а) s-електронних хмар двох атомів; б) s-електронної хмари одного атома і р-електронної хмари іншого атома (за будь-якою з осей х, у, z).<br>7. Наведи електронну конфігурацію атома Оксигену і схему розподілу електронів за орбіталями зовнішнього енергетичного рівня атома. Зроби висновок, скільки електронів атома Оксигену можуть брати участь в утворенні ковалентних зв'язків з атомами Гідрогену?<br>8. Напиши електронні й структурні формули хлору СІ<sub>2</sub>, сірководню H<sub>2</sub>S, амоніаку NH<sub>3</sub>.<br>9. На підставі будови атомів Сульфуру й Гідрогену, поясни склад і будову молекули гідроген сульфіду H<sub>2</sub>S.''<br><br>'''Додаткові завдання '''<br>''10*. Неполярні молекули у речовини<br>(а) НСІ; (в) NH<sub>3</sub>;<br>(б) CF<sub>4</sub>; (г) H<sub>2</sub>S.<br>11*. Прикладом неполярної молекули, що містить полярний ковалентний зв'язок, є<br>(а) N<sub>2</sub>; (в) NH<sub>3</sub>;<br>(б) Н<sub>2</sub>О; (г) ССІ<sub>4</sub>.<br>12*. Під час утворення молекули НСІ перекриваються орбіталі типу (а) pip; (в) sis; б) sip; (r)ofip.''<br> |
| | | | |
| - | ----
| + | <br> |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту<br> | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту<br>'' |
| | | | |
| | <br> <sub>Допомога школяру [[Гіпермаркет Знань - перший в світі!|8 класу]], підручники онлайн, підручник з [[Хімія|хімії]]</sub> <br> | | <br> <sub>Допомога школяру [[Гіпермаркет Знань - перший в світі!|8 класу]], підручники онлайн, підручник з [[Хімія|хімії]]</sub> <br> |
Текущая версия на 08:24, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Ковалентний зв’язок, його види — полярний і неполярний. Утворення ковалентного неполярного зв’язку. Утворення ковалентного полярного зв’язку
Суть хімічного зв'язку. Атоми різних елементів, що входять до складу простих чи складних речовин, утримуються разом завдяки наявності хімічного зв'язку. В його утворенні беруть участь кулонівські сили, носіями яких є електрони і ядра атомів.
Хімічний зв'язок виникає внаслідок взаємодії позитивно заряджених ядер і негативно заряджених електронів.
Уяви собі, що два атоми Гідрогену перебувають на дуже великій відстані один від одного. Вони не взаємодіють між собою. У разі їх зближення починають діяти сили притягання між ядром одного атома та електроном іншого, а також сили відштовхування між ядрами і між електронами обох атомів. На деякій відстані сили притягання переважають сили відштовхування. При дальшому зближенні атомів, навпаки, сили відштовхування починають переважати сили притягання. Тому потенціальна енергія системи у разі зближення атомів Гідрогену спочатку знижується, а потім підвищується. Якщо ж сили притягання дорівнюють силам відштовхування, то енергія системи в цьому випадку найменша. Такий стан системи найстійкіший, він відповідає утворенню молекули Н2. Отже, хімічний зв'язок — це взаємодія атомів або будь- яких інших частинок у речовині, яка зумовлює їхнє сполучення в молекули чи кристали.
Така взаємодія спричинює зменшення енергії утвореної молекули (кристала) порівняно з енергією поодиноких атомів, що взаємодіють.
Існує кілька типів хімічного зв'язку: ковалентний, йонний, металічний та ін.
Ковалентний неполярний зв'язок.
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.
Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
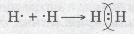
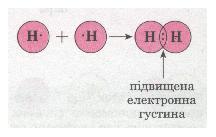
Мал. 23. Схема утворення хімічного зв'язку між атомами.
Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.
Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F2. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:
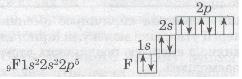
Мал. 24. Структурна формула водню.
У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
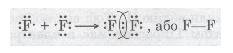
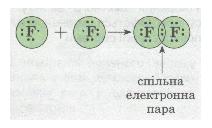
Мал. 25. Електронна пара.
У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.
Хімічний зв'язок, який утворюється за допомогою спільних електронних пар, називають ковалентним зв'язком.
Слово «ковалентний» означає «спільновалентний»: атоми разом володіють усуспільненими валентними електронами.
У розглянутих випадках спільна електронна пара належить обом атомам однаковою мірою. Такий ковалентний зв'язок називають неполярним. Він виникає під час взаємодії атомів неметалів одного й того самого хімічного елемента, оскільки в них однакова електронегативність. Так, у молекулах Н2, О2, F2, Сl2 існує неполярний ковалентний зв'язок.
Кратність ковалентного зв'язку. Бувають випадки, коли два атоми усуспільнюють кілька пар валентних електронів. У такому разі говорять про кратність ковалентного зв'язку. Якщо між атомами виникла одна спільна електронна пара, то такий ковалентний зв'язок називають одинарним, якщо дві — подвійним, якщо три — потрійним. Розглянь, наприклад, схему утворення потрійного ковалентного зв'язку в молекулі азоту N2:

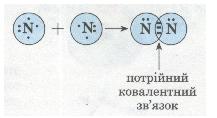
Мал. 26. Схема утворення потрійного ковалентного зв'язку.
Ковалентний полярний зв'язок. Якщо атоми, що взаємодіють, мають різну електронегативність (атоми різних неметалів), то спільна електронна пара зміщується до атома з більшою електроне-гативністю. У цьому разі виникає полярний ковалентний зв'язок. Наприклад, у молекулі флуороводню HF зв'язок ковалентний полярний:
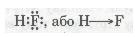
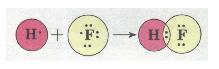
Мал. 27. Полярний ковалентний зв'язок.
У результаті зміщення електронної пари в молекулі HF (стрілка показує напрямок зміщення) молекула стає полярною, виникає диполь.
Диполь — це система з двох зарядів, однакових за величиною і протилежних за знаком.
Вважають, що атом, до якого зміщена електронна пара, набуває деякого негативного заряду, а атом, від якого зміщена електронна пара, — деякого позитивного заряду:
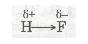
(гр. літера δ (дельта) позначає частковий заряд, тобто менший за одиничний).
Полярний ковалентний зв'язок незавжди зумовлює утворення диполя. Наприклад, у разі формування молекули карбон(ІV) оксиду С02 електронні пари зміщуються до Оксигену як до більш електронегативного елемента. Але диполь не виникає, бо молекула симетрична.
Молекули води Н2О, навпаки, мають кутову будову. Полярні зв'язки О—Н розміщені під кутом 104,5°, що спричинює несиметричність структури і полярність молекул води:
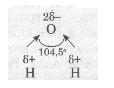
Кутові молекули сірководню H2S, пірамідальні молекули амоніаку NH3 також мають несиметричну структуру, тому вони полярні (мал. 28).
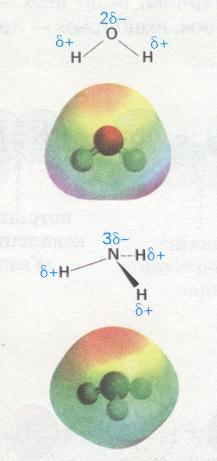
Мал. 28. Полярні молекули води та амоніаку
Бувають випадки, коли кількість хімічних зв'язків, утворених атомом у сполуці, більша за кількість неспарених електронів на зовнішньому енергетичному рівні атома. Так, у атомі Карбону на зовнішньому рівні всього два неспарені електрони, але номер групи, в якій він розміщений, засвідчує, що в атомі має бути 4 валентні електрони. Звідки ж беруться ще два неспарені електрони?
Згадаємо електронну формулу Карбону:
6С 1s22s22p2
Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:
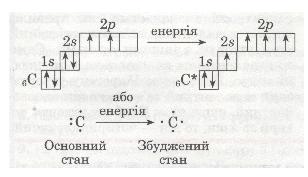
Мал. 29. Розпарювання електронної пари.
Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами.
За кількістю утворених ковалентних зв'язків визначають валентність елемента. Валентність (від лат. valentia — сила) — це здатність атома приєднувати певне число інших атомів. Ця здатність залежить від кількості неспарених електронів атома в основному або збудженому стані, що беруть участь в утворенні спільних електронних пар з електронами інших атомів. Величина валентності визначається, як правило, числом ковалентних зв'язків, які даний атом утворює з іншими атомами. Саме тому валентність не має знака — ні плюс, ні мінус. Якщо атом Гідрогену утворює один ковалентний зв'язок, то він одновалентний, якщо атом Карбону утворює чотири зв'язки, то він — чотиривалентний.
ВИСНОВКИ
Хімічний зв'язок — це сила, яка утримує атоми (будь-які частинки) в хімічній сполуці. Вона виникає внаслідок взаємодії ядер і електронів. Хімічний зв'язок, що зумовлений утворенням спільних електронних пар, називається ковалентним. Він може бути полярним і неполярним залежно від того, які атоми з'єднуються: якщо однакові — неполярний, якщо різні за електронегативністю — полярний. Залежно від кількості спільних електронних пар, ковалентний зв'язок буває одинарним, подвійним, потрійним.
Спільні електронні пари утворюються внаслідок об'єднання неспаре-их валентних електронів атомів неметалів.
За кількістю неспарених електронів атома або кількістю утворених ковалентних зв'язків визначають валентність елемента. У результаті утворення хімічного зв'язку атоми набувають стійкого завершеного зовнішнього енергетичного рівня.
Завдання для самоконтролю
1. Як ти розумієш зміст поняття «хімічний зв'язок»? За рахунок чого він виникає?
2. Як утворюється ковалентний зв'язок? Які види ковалентного зв'язку ти знаєш? Чим вони подібні й чим відрізняються один від одного? Відповідь ілюструй прикладами.
3. В яких речовинах існує лише неполярний ковалентний зв'язок? Чому?
4. Чому молекули інертних газів, на відміну від усіх інших неметалів, у вільному стані одноатомні?
5. Напиши електронну і структурну формули гідроген пероксиду Н2О2. Обчисли, скільки електронів міститься на зовнішньому енергетичному рівні атома Оксигену, скільки хімічних зв'язків у цій молекулі. Визнач тип кожного хімічного зв'язку.
6. Намалюй схему перекривання: а) s-електронних хмар двох атомів; б) s-електронної хмари одного атома і р-електронної хмари іншого атома (за будь-якою з осей х, у, z).
7. Наведи електронну конфігурацію атома Оксигену і схему розподілу електронів за орбіталями зовнішнього енергетичного рівня атома. Зроби висновок, скільки електронів атома Оксигену можуть брати участь в утворенні ковалентних зв'язків з атомами Гідрогену?
8. Напиши електронні й структурні формули хлору СІ2, сірководню H2S, амоніаку NH3.
9. На підставі будови атомів Сульфуру й Гідрогену, поясни склад і будову молекули гідроген сульфіду H2S.
Додаткові завдання
10*. Неполярні молекули у речовини
(а) НСІ; (в) NH3;
(б) CF4; (г) H2S.
11*. Прикладом неполярної молекули, що містить полярний ковалентний зв'язок, є
(а) N2; (в) NH3;
(б) Н2О; (г) ССІ4.
12*. Під час утворення молекули НСІ перекриваються орбіталі типу (а) pip; (в) sis; б) sip; (r)ofip.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Допомога школяру 8 класу, підручники онлайн, підручник з хімії
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|




















