|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Молярна маса. Повні уроки
Тема
Мета уроку
Задачі уроку1. Ознайомитися з новою величиною “молярна маса”, з її одиницями виміру і позначенням. Хід урокуПоняття “молярна маса”, її одиниці виміру і позначенняХімічні речовини реагують між собою в кількостях, пропорційних стехіометрічним коефіцієнтам в рівнянні реакції. При цьому значення мас реагуючих речовин ніяк не визначаються безпосередньо рівнянням реакції і непропорційні стехіометрічним коефіцієнтам. Тому для кількісного опису реакцій доцільніше використовувати кількість речовини, а не його масу, хоча порція речовини найзручніше відміряється по масі речовини (або за його обсягом). Щоб співвіднести між собою кількість речовини і його масу, введено поняття про молярну масу, одиницю кількості речовини, що відповідає. Молярна маса позначається M (наприклад, M(NAOH)= 40.00 г/міль). Молярна маса речовини є відношення маси деякої порції цієї речовини до кількості речовини в цій порції M= m/n. Молярна маса - величина, що характеризує конкретну речовину. Одиницею молярної маси в СІ є кілограм на моль (кг/моль), в хімічній практиці найчастіше використовується одиниця - грам на моль (г/моль). Числове значення молярної маси, вираженої в г/моль, для одноатомної простої речовини дорівнює відносній атомній масі даного елементу, а для будь-якого з'єднання - його відносній молекулярній масі Приклад. Mr(H2so4)= 98.08 а.е.м.; M(H2so4)= 98,08 г/моль. Це відео допоможе вам краще зрозуміти поняття «моль» та «молярна маса».
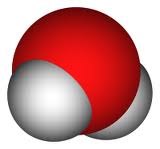
Відео 1.Моль- одиниця кількості речовини. Молярна маса. Подивіться на Малюнок 1. На ньому зображена молекула води. Молярна маса води 18,01528 г/моль . Малюнок 1. Молярна маса води. На Малюнку 2 ви бачите хімічний елемент, який оточує нас завжди, - повітря. Молярна маса повітря - 29г/моль. Малюнок 2. Повітря. На цьому відео вам детально розкажуть про найлегший хімічний елемент - водень. Він є першим елементом в періодичному системі хімічних елементів Менделєєва Д.І.
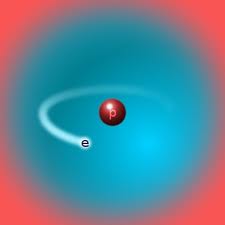
Відео 2. Водень – найлегший хімічний елемент. На цьому малюнку ви побачите модель атому водня – протій. Малюнок 3. Протій. Контролюючий блок № 11. Яке з тверджень правильне? Приклади вирішування завдань з поняттям «молярна маса»У цій частині ми розглянемо приклади вирішування завдань, у яких зустрічається поняття «молярна маса». Молярна маса – це фізична величина , яка дорівнює відношенню маси речовини до кількості речовини. M = m/n, вірні і зворотні формули: Задача 1. m(NaOH)=80г.N (NaOH)=? Розв’язання Спочатку знайдемо, якій кількості речовини відповідає ця маса: Відповідь: N (NaOH) = 12,04*1022 молекул. Знаючи кількість речовини і молярну масу, легко розрахувати масу речовини. Малюнок 4. Гідроксид натрію(NaOH) Задача 2. n (NaOH)= 2моль; m = ? Розв’язання. m = M • n; Відповідь: 80 г. Знаючи масу і кількість речовини, можна визначити молярну масу. Задача 3. m=80г; n=2моль; М = ? Розв’язання. M = m/n; M=80/2; М=40 г/моль. Відповідь: 40 г/моль. На цьому малюнку ви бачите повітря, яке наповнене киснем. Кисень – газ, без якого не зможе існувати жодна жива клітина на Землі. Малюнок 5. Кисень(O2) Давайте подивимося відео-урок учнів. Що ви можете сказати і які висновки зробити? Чи правильно учні розрахували задачу?
Відео 3. Знаходження молярної маси речовини. Контролюючий блок № 2Доповните пропозиції, в зошит запишіть пропозиції цілком: Цікаво знати, що …Чи знаєте ви яка найлегша речовина? Газоподібні речовини легше рідин і твердих речовин. Найлегший газ - ВОДЕНЬ. Можна вирахувати. Потрібно дивитися по молярній масі. Молярна маса повітря дорівнює 29 г/міль. Молярна маса водню дорівнює 2 г/міль. Водень легше за повітря в 14,5 разу. Газоподібну речовину з меншою молярною масою ви не знайдете. Відповідно, водень - найлегша речовина на Землі. Список використаних джерел1. Урок «Молярная масса» Горохова Н.П. учитель Комсомольской средней школы №2 .
Макаринська Я.Ю. Басько С. Ю. Лоренко Л.П
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: