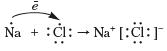|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Періодичний закон і періодична система хімічних елементів Д.І. Меделєєва. Будова атома і види хімчного зв'язку<metakeywords>Періодичний закон і періодична система хімічних елементів Д.І. Меделєєва. Будова атома і види хімчного зв'язку</metakeywords>''' <br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Періодичний закон і періодична система хімічних елементів Д.І. Меделєєва. Будова атома і види хімічного зв'язку<metakeywords>Періодичний закон і періодична система хімічних елементів Д.І. Меделєєва. Будова атома і види хімчного зв'язку</metakeywords>''' <br> |
| | | | |
| - | '''Періодичний закон і будова атома. Види хімічного зв'язку'''<br>''Назвіть елементи V групи головної і побічної підгруп. У чому проявляється подібність властивостей сполук елементів цієї групи?''<br>[[41. Періодичний закон та періодична система хімічних елементів Д. І. Менделєєва|'''Період''']] — це горизонтальний ряд [[Атоми, молекули, йони. Хімічні елементи, їхні назви і символи|хімічних елементів]], розміщених у порядку зростання їх [[Атомна одиниця маси. Відносна атомна маса хімічних елементів|атомних мас]], що розпочинається [[40. Історичні відомості про спроби класифiкації хiмічних елементів. Поняття про лужні, інертні елементи, галогени|лужним металічним елементом]], а завершується [[Тема 15. Історичні відомості про спроби класифiкації хiмічних елементів. Поняття про лужні, інертні елементи, галогени|інертним елементом]].<br>''► Порівняйте перший, третій і четвертий періоди періодичної системи та зробіть висновок, чому, незважаючи на різну кількість елементів у першому і третьому періодах, їх відносять до малих періодів, а четвертий — до великих. Який період не розпочинається лужним металічним елементом, а який не завершується інертним елементом?'''''<br>'''Підтвердженням періодичної зміни властивостей хімічних елементів, форм і властивостей їх сполук є те, що кожна група має елементи з подібними властивостями й однаковою формою [[12. Оксиди, їх склад, назви|оксидів]], гідратів оксидів, летких водневих сполук. Тому не випадково в нижній частині системи для кожної групи часто зазначають загальні формули вищих оксидів і летких водневих сполук неметалічних елементів.<br>Місце кожного хімічного елемента в періодичній системі чітко визначене (виняток становить Гідроген, його розташовують і в першій, і в сьомій групах), за кожним елементом закріплений його порядковий номер.<br>[[Атоми і хімічні елементи. Акселеративна вправа|Атоми]] складаються з ядра та електронної оболонки. У ядрі містяться протони та нейтрони.<br>Користуючись періодичною системою, укажіть, скільки протонів, нейтронів та електронів міститься в атомах хімічних елементів з порядковими номерами 30 і 31.<br>Відкриття [[Фізика і астрономія|фізиками]] на початку ХХ ст. складної будови атома підтвердило геніальність [[Поняття про періодичну систему хімічних елементів Д. І. Менделєєва. Повні уроки|Д. І. Менделєєва]] як творця періодичного закону. Виявилося, що всі без винятку хімічні елементи розташовані в періодичній системі за зростанням заряду ядер їх атомів. А періодична зміна властивостей елементів і їх сполук пов'язана з особливостями будови атомів хімічних елементів у межах однієї групи й одного періоду. Це дало підстави для сучасного формулювання періодичного закону.<br>Властивості хімічних елементів, а також утворених ними сполук перебувають у періодичній залежності від величини зарядів ядер їх атомів.<br>З'ясування фізичної суті періодичного закону значно розширило інформаційну функцію періодичної системи. Відомо, що:<br>• порядковий номер хімічного елемента вказує на величину заряду ядра атома, кількість протонів у ядрі — на кількість електронів у електронній оболонці атома;<br>• кількість нейтронів у ядрі атома дорівнює різниці між відносною атомною масою хімічного елемента та його порядковим номером;<br>• номер періоду збігається з кількістю енергетичних рівнів (електронних шарів) в електронній оболонці атома;<br>• хімічні елементи однієї підгрупи мають однакову електронну формулу зовнішнього енергетичного рівня (електронного шару);<br>• в елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні збігається з номером групи;<br>• вища валентність атомів хімічного елемента в оксидах дорівнює номеру групи (існують винятки);<br>• кількість неспарених електронів в атомах неметалічних елементів У-УІІ груп можна визначити дією віднімання: 8 — номер групи.<br>Електронні формули атомів. В атомі не існує навіть двох однакових електронів. Це є підставою для написання електронних формул атомів, у яких відображено відмінності між формою атомних орбіталей (геометричних образів об'єму навколоядерного простору, у якому ймовірність перебування електрона дорівнює 90-95 %), указано кількість електронів на підрівнях і рівнях.<br>Електронна формула атома — це запис розподілу електронів в атомі, у якому числами позначають енергетичні рівні (1, 2 ...), літерами — підрівні (з, р, д, /), а верхніми індексами — кількість електронів на підрівнях. Наприклад: [[Image:H1038.jpg|Формула. фото]]<br>Графічні електронні формули доповнюють інформацію про будову електронної оболонки атома відомостями про кількість енергетичних комірок (кожну комірку позначають квадратиком) та заповнення їх електронами. Два спарені електрони однієї комірки позначають двома протилежно спрямованими стрілками рений електрон — однією.<br>Графічна [[59. Електронні формули молекул речовин|електронна формула]] — це відображення розподілу електронів в електронній оболонці атома за допомогою енергетичних комірок і стрілок.<br>Приклад графічної електронної формули, де енергетичні комірки зображені об'ємно, наведено на рисунку 1.
| + | <br>''Назвіть елементи V групи головної і побічної підгруп. У чому проявляється подібність властивостей сполук елементів цієї групи?'' |
| | | | |
| - | [[Image:H1039.jpg|Об'ємне зображення графічної електронної формули атома Силіцію. фото]]<br>''Напишіть електронну й графічну електронну формули хімічних елементів із порядковими номерами 2 і 13. У якого з атомів відсутні неспарені електрони?''<br>Види [[Хімічний зв’язок і будова речовин|хімічного зв'язку]]. Основою теорії хімічного зв'язку є положення про те, що утворення хімічних зв'язків супроводжується досягненням атомами завершеної будови зовнішнього енергетичного рівня.<br>Зовнішній енергетичний рівень уважається завершеним, якщо він містить 8 електронів (для Гідрогену та Гелію — 2). При утворенні хімічних зв'язків ядра атомів не змінюються; зміни відбуваються лише в електронних оболонках.<br>Хімічним зв'язком називають взаємодію між атомами, що зумовлює утворення молекул і кристалів.<br>Ви вже вивчали ковалентний, йонний та водневий зв'язки.<br>Повторимо утворення ковалентного та йонного зв'язків на прикладі сполук хімічних елементів із порядковими номерами 1, 8, 11, 17.<br>Спочатку запишемо електронні й графічні електронні формули атомів зазначених елементів: | + | <br>[[41. Періодичний закон та періодична система хімічних елементів Д. І. Менделєєва|'''Період''']] — це горизонтальний ряд [[Атоми, молекули, йони. Хімічні елементи, їхні назви і символи|хімічних елементів]], розміщених у порядку зростання їх [[Атомна одиниця маси. Відносна атомна маса хімічних елементів|атомних мас]], що розпочинається [[40. Історичні відомості про спроби класифiкації хiмічних елементів. Поняття про лужні, інертні елементи, галогени|лужним металічним елементом]], а завершується [[Тема 15. Історичні відомості про спроби класифiкації хiмічних елементів. Поняття про лужні, інертні елементи, галогени|інертним елементом]]. |
| | + | |
| | + | <br>Порівняйте перший, третій і четвертий періоди періодичної системи та зробіть висновок, чому, незважаючи на різну кількість елементів у першому і третьому періодах, їх відносять до малих періодів, а четвертий — до великих.''Який період не розпочинається лужним металічним елементом, а який не завершується інертним елементом? |
| | + | |
| | + | '''<br>'''Підтвердженням періодичної зміни властивостей хімічних елементів, форм і властивостей їх сполук є те, що кожна група має елементи з подібними властивостями й однаковою формою [[12. Оксиди, їх склад, назви|оксидів]], гідратів оксидів, летких водневих сполук. Тому не випадково в нижній частині системи для кожної групи часто зазначають загальні формули вищих оксидів і летких водневих сполук неметалічних елементів. |
| | + | |
| | + | <br>Місце кожного хімічного елемента в періодичній системі чітко визначене (виняток становить Гідроген, його розташовують і в першій, і в сьомій групах), за кожним елементом закріплений його порядковий номер.<br>[[Атоми і хімічні елементи. Акселеративна вправа|Атоми]] складаються з ядра та електронної оболонки. У ядрі містяться протони та нейтрони. |
| | + | |
| | + | <br>Користуючись періодичною системою, укажіть, скільки протонів, нейтронів та електронів міститься в атомах хімічних елементів з порядковими номерами 30 і 31. |
| | + | |
| | + | <br>Відкриття [[Фізика і астрономія|фізиками]] на початку ХХ ст. складної будови атома підтвердило геніальність [[Поняття про періодичну систему хімічних елементів Д. І. Менделєєва. Повні уроки|Д. І. Менделєєва]] як творця періодичного закону. Виявилося, що всі без винятку хімічні елементи розташовані в періодичній системі за зростанням заряду ядер їх атомів. А періодична зміна властивостей елементів і їх сполук пов'язана з особливостями будови атомів хімічних елементів у межах однієї групи й одного періоду. Це дало підстави для сучасного формулювання періодичного закону. |
| | + | |
| | + | <br>Властивості хімічних елементів, а також утворених ними сполук перебувають у періодичній залежності від величини зарядів ядер їх атомів. |
| | + | |
| | + | <br>З'ясування фізичної суті періодичного закону значно розширило інформаційну функцію періодичної системи. |
| | + | |
| | + | '''Відомо, що:'''<br> |
| | + | |
| | + | *порядковий номер хімічного елемента вказує на величину заряду ядра атома, кількість протонів у ядрі — на кількість електронів у електронній оболонці атома; |
| | + | *кількість нейтронів у ядрі атома дорівнює різниці між відносною атомною масою хімічного елемента та його порядковим номером; |
| | + | *номер періоду збігається з кількістю енергетичних рівнів (електронних шарів) в електронній оболонці атома; |
| | + | *хімічні елементи однієї підгрупи мають однакову електронну формулу зовнішнього енергетичного рівня (електронного шару); |
| | + | *в елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні збігається з номером групи; |
| | + | *вища валентність атомів хімічного елемента в оксидах дорівнює номеру групи (існують винятки); |
| | + | *кількість неспарених електронів в атомах неметалічних елементів У-УІІ груп можна визначити дією віднімання: 8 — номер групи. |
| | + | |
| | + | |
| | + | |
| | + | '''Електронні формули атомів'''. В атомі не існує навіть двох однакових електронів. Це є підставою для написання електронних формул атомів, у яких відображено відмінності між формою атомних орбіталей (геометричних образів об'єму навколоядерного простору, у якому ймовірність перебування електрона дорівнює 90-95 %), указано кількість електронів на підрівнях і рівнях. |
| | + | |
| | + | <br>Електронна формула атома — це запис розподілу електронів в атомі, у якому числами позначають енергетичні рівні (1, 2 ...), літерами — підрівні (з, р, д, /), а верхніми індексами — кількість електронів на підрівнях. Наприклад: |
| | + | |
| | + | [[Image:H1038.jpg|Формула. фото]] |
| | + | |
| | + | <br>Графічні електронні формули доповнюють інформацію про будову електронної оболонки атома відомостями про кількість енергетичних комірок (кожну комірку позначають квадратиком) та заповнення їх електронами. Два спарені електрони однієї комірки позначають двома протилежно спрямованими стрілками рений електрон — однією.<br>Графічна [[59. Електронні формули молекул речовин|електронна формула]] — це відображення розподілу електронів в електронній оболонці атома за допомогою енергетичних комірок і стрілок. |
| | + | |
| | + | <br>Приклад графічної електронної формули, де енергетичні комірки зображені об'ємно, наведено на рисунку 1. |
| | + | |
| | + | |
| | + | |
| | + | [[Image:H1039.jpg|Об'ємне зображення графічної електронної формули атома Силіцію. фото]] |
| | + | |
| | + | ''Напишіть електронну й графічну електронну формули хімічних елементів із порядковими номерами 2 і 13. У якого з атомів відсутні неспарені електрони?'' |
| | + | |
| | + | <br>'''Види '''[[Хімічний зв’язок і будова речовин|'''хімічного зв'язку''']]. Основою теорії хімічного зв'язку є положення про те, що утворення хімічних зв'язків супроводжується досягненням атомами завершеної будови зовнішнього енергетичного рівня.<br>Зовнішній енергетичний рівень уважається завершеним, якщо він містить 8 електронів (для Гідрогену та Гелію — 2). При утворенні хімічних зв'язків ядра атомів не змінюються; зміни відбуваються лише в електронних оболонках.<br>Хімічним зв'язком називають взаємодію між атомами, що зумовлює утворення молекул і кристалів.<br>Ви вже вивчали ковалентний, йонний та водневий зв'язки. |
| | + | |
| | + | <br>Повторимо утворення ковалентного та йонного зв'язків на прикладі сполук хімічних елементів із порядковими номерами 1, 8, 11, 17. |
| | + | |
| | + | <br>Спочатку запишемо електронні й графічні електронні формули атомів зазначених елементів: |
| | | | |
| | [[Image:H1040.jpg|Формули. фото]]<br>Ви вже знаєте про існування двохатомних молекул простих речовин водню Н2 і [[Оксиген. Кисень, склад його молекули, фізичні властивості|кисню]] О2, молекул [[Вода. Акселеративні методи|води]] Н2О та речовини не-молекулярної будови натрій хлориду КаСІ. Пригадаємо, яким способом атоми Гідрогену, Оксигену, Хлору та Натрію досягали завершеної будови зовнішнього енергетичного рівня в кожній з цих речовин.<br>Наявний в атома Гідрогену 1 електрон становить половину від кількості завершеного для нього (двохелектронного) зовнішнього енергетичного рівня. В Оксигену на зовнішньому енергетичному рівні 6 електронів, тобто він близький до завершеного для нього восьмиелектронного складу. Маючи половину й більше половини електронів, аніж їх є на завершеному енергетичному рівні, атомам цих елементів енергетично вигідніше не віддавати електрони, а приєднувати або утворювати спільні електронні пари. Так, у молекулі водню два атоми Гідрогену досягають завершеності зовнішнього енергетичного рівня за рахунок утворення однієї спільної електронної пари, у молекулі кисню — двох (рис. 2). | | [[Image:H1040.jpg|Формули. фото]]<br>Ви вже знаєте про існування двохатомних молекул простих речовин водню Н2 і [[Оксиген. Кисень, склад його молекули, фізичні властивості|кисню]] О2, молекул [[Вода. Акселеративні методи|води]] Н2О та речовини не-молекулярної будови натрій хлориду КаСІ. Пригадаємо, яким способом атоми Гідрогену, Оксигену, Хлору та Натрію досягали завершеної будови зовнішнього енергетичного рівня в кожній з цих речовин.<br>Наявний в атома Гідрогену 1 електрон становить половину від кількості завершеного для нього (двохелектронного) зовнішнього енергетичного рівня. В Оксигену на зовнішньому енергетичному рівні 6 електронів, тобто він близький до завершеного для нього восьмиелектронного складу. Маючи половину й більше половини електронів, аніж їх є на завершеному енергетичному рівні, атомам цих елементів енергетично вигідніше не віддавати електрони, а приєднувати або утворювати спільні електронні пари. Так, у молекулі водню два атоми Гідрогену досягають завершеності зовнішнього енергетичного рівня за рахунок утворення однієї спільної електронної пари, у молекулі кисню — двох (рис. 2). |
| | | | |
| - | [[Image:H1041.jpg|350px|Схеми утворення хімічного зв'язку між атомами одного хімічного елемента. фото]]<br>В обох молекулах спільні електронні пари рівновіддалені від ядер атомів, між якими утворився хімічний зв'язок.<br>У молекулі води атоми також сполучені спільними електронними парами (рис. 3), зміщеними ближче до ядра атома Оксигену.
| |
| | | | |
| - | [[Image:H1042.jpg|Утворення хімічного зв'зку в молекулы води. фото]]<br>Зміщення електронних пар відбулося тому, що Оксиген, порівняно з Гідрогеном, має більшу електронегативність — умовну величину, яка характеризує здатність атома в сполуці притягувати до себе електрони.<br>Неметалічні елементи характеризуються високою, порівняно з металічними, електронегативністю, тому між атомами неметалічних елементів хімічний зв'язок утворюється за рахунок спільних електронних пар, а не шляхом віддавання й приєднання електронів.<br>Хімічний зв'язок за допомогою спільних електронних пар називається ковалентним. Якщо спільні електронні пари рівновіддалені від ядер обох атомів, він — неполярний, а якщо зміщені в бік більш електронегативного атома — полярний.<br>''► Напишіть електронну формулу атома Неону. Висловіть припущення про хімічну активність атомів цього хімічного елемента.<br>Поясніть, який вид ковалентного зв'язку утворюється між атомами: а) Гідрогену і Брому в гідроген броміді НВг; б) між атомами Брому в молекулі брому Вг2.''<br>Натрій хлорид, на відміну від водню, кисню й води, є речовиною немолекулярної будови. Тож утворення хімічного зв'язку відбувається по-іншому. Атом Натрію віддає єдиний електрон зовнішнього енергетичного рівня й перетворюється на катіон, у якого завершений зовнішній енергетичний рівень (ним стає передостанній енергетичний рівень атома Натрію). Тому Хлору енергетично вигідно приєднати цей електрон на зовнішній енергетичний рівень і завершити його. При цьому нейтральні атоми Натрію та Хлору перетворюються на заряджені частинки — йони:
| |
| | | | |
| - | [[Image:H1043.jpg|формула. фото]]<br>Зв'язок, що утворюється в речовинах за рахунок притягування різнойменно заряджених йонів, називається '''[[60. Йонний зв’язок|йонним зв'язком]].'''<br>Електронейтральні атоми всіх металічних елементів здатні до віддавання, а не до приєднання електронів.<br>Зробіть висновок про можливість існування аніонів у Гідрогену та металічних елементів.<br> | + | [[Image:H1041.jpg|350px|Схеми утворення хімічного зв'язку між атомами одного хімічного елемента. фото]]<br> |
| | + | |
| | + | В обох молекулах спільні електронні пари рівновіддалені від ядер атомів, між якими утворився хімічний зв'язок.<br>У молекулі води атоми також сполучені спільними електронними парами (рис. 3), зміщеними ближче до ядра атома Оксигену. |
| | + | |
| | + | |
| | + | |
| | + | [[Image:H1042.jpg|Утворення хімічного зв'зку в молекулы води. фото]]<br>Зміщення електронних пар відбулося тому, що Оксиген, порівняно з Гідрогеном, має більшу електронегативність — умовну величину, яка характеризує здатність атома в сполуці притягувати до себе електрони.<br>Неметалічні елементи характеризуються високою, порівняно з металічними, електронегативністю, тому між атомами неметалічних елементів хімічний зв'язок утворюється за рахунок спільних електронних пар, а не шляхом віддавання й приєднання електронів. |
| | + | |
| | + | <br>Хімічний зв'язок за допомогою спільних електронних пар називається ковалентним. Якщо спільні електронні пари рівновіддалені від ядер обох атомів, він — неполярний, а якщо зміщені в бік більш електронегативного атома — полярний. |
| | + | |
| | + | <br>''Напишіть електронну формулу атома Неону. Висловіть припущення про хімічну активність атомів цього хімічного елемента.'' |
| | + | |
| | + | ''<br>Поясніть, який вид ковалентного зв'язку утворюється між атомами: а) Гідрогену і Брому в гідроген броміді НВг; б) між атомами Брому в молекулі брому Вг2.'' |
| | + | |
| | + | <br>Натрій хлорид, на відміну від водню, кисню й води, є речовиною немолекулярної будови. Тож утворення хімічного зв'язку відбувається по-іншому. Атом Натрію віддає єдиний електрон зовнішнього енергетичного рівня й перетворюється на катіон, у якого завершений зовнішній енергетичний рівень (ним стає передостанній енергетичний рівень атома Натрію). Тому Хлору енергетично вигідно приєднати цей електрон на зовнішній енергетичний рівень і завершити його. При цьому нейтральні атоми Натрію та Хлору перетворюються на заряджені частинки — йони: |
| | + | |
| | + | |
| | + | |
| | + | [[Image:H1043.jpg|формула. фото]]<br> |
| | + | |
| | + | Зв'язок, що утворюється в речовинах за рахунок притягування різнойменно заряджених йонів, називається '''[[60. Йонний зв’язок|йонним зв'язком]].''' |
| | + | |
| | + | <br>Електронейтральні атоми всіх металічних елементів здатні до віддавання, а не до приєднання електронів.<br>Зробіть висновок про можливість існування аніонів у Гідрогену та металічних елементів.<br> |
| | | | |
| | <br> | | <br> |
Текущая версия на 14:13, 13 сентября 2012
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Періодичний закон і періодична система хімічних елементів Д.І. Меделєєва. Будова атома і види хімічного зв'язку
Назвіть елементи V групи головної і побічної підгруп. У чому проявляється подібність властивостей сполук елементів цієї групи?
Період — це горизонтальний ряд хімічних елементів, розміщених у порядку зростання їх атомних мас, що розпочинається лужним металічним елементом, а завершується інертним елементом.
Порівняйте перший, третій і четвертий періоди періодичної системи та зробіть висновок, чому, незважаючи на різну кількість елементів у першому і третьому періодах, їх відносять до малих періодів, а четвертий — до великих.Який період не розпочинається лужним металічним елементом, а який не завершується інертним елементом?
Підтвердженням періодичної зміни властивостей хімічних елементів, форм і властивостей їх сполук є те, що кожна група має елементи з подібними властивостями й однаковою формою оксидів, гідратів оксидів, летких водневих сполук. Тому не випадково в нижній частині системи для кожної групи часто зазначають загальні формули вищих оксидів і летких водневих сполук неметалічних елементів.
Місце кожного хімічного елемента в періодичній системі чітко визначене (виняток становить Гідроген, його розташовують і в першій, і в сьомій групах), за кожним елементом закріплений його порядковий номер.
Атоми складаються з ядра та електронної оболонки. У ядрі містяться протони та нейтрони.
Користуючись періодичною системою, укажіть, скільки протонів, нейтронів та електронів міститься в атомах хімічних елементів з порядковими номерами 30 і 31.
Відкриття фізиками на початку ХХ ст. складної будови атома підтвердило геніальність Д. І. Менделєєва як творця періодичного закону. Виявилося, що всі без винятку хімічні елементи розташовані в періодичній системі за зростанням заряду ядер їх атомів. А періодична зміна властивостей елементів і їх сполук пов'язана з особливостями будови атомів хімічних елементів у межах однієї групи й одного періоду. Це дало підстави для сучасного формулювання періодичного закону.
Властивості хімічних елементів, а також утворених ними сполук перебувають у періодичній залежності від величини зарядів ядер їх атомів.
З'ясування фізичної суті періодичного закону значно розширило інформаційну функцію періодичної системи.
Відомо, що:
- порядковий номер хімічного елемента вказує на величину заряду ядра атома, кількість протонів у ядрі — на кількість електронів у електронній оболонці атома;
- кількість нейтронів у ядрі атома дорівнює різниці між відносною атомною масою хімічного елемента та його порядковим номером;
- номер періоду збігається з кількістю енергетичних рівнів (електронних шарів) в електронній оболонці атома;
- хімічні елементи однієї підгрупи мають однакову електронну формулу зовнішнього енергетичного рівня (електронного шару);
- в елементів головних підгруп кількість електронів на зовнішньому енергетичному рівні збігається з номером групи;
- вища валентність атомів хімічного елемента в оксидах дорівнює номеру групи (існують винятки);
- кількість неспарених електронів в атомах неметалічних елементів У-УІІ груп можна визначити дією віднімання: 8 — номер групи.
Електронні формули атомів. В атомі не існує навіть двох однакових електронів. Це є підставою для написання електронних формул атомів, у яких відображено відмінності між формою атомних орбіталей (геометричних образів об'єму навколоядерного простору, у якому ймовірність перебування електрона дорівнює 90-95 %), указано кількість електронів на підрівнях і рівнях.
Електронна формула атома — це запис розподілу електронів в атомі, у якому числами позначають енергетичні рівні (1, 2 ...), літерами — підрівні (з, р, д, /), а верхніми індексами — кількість електронів на підрівнях. Наприклад:
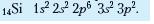
Графічні електронні формули доповнюють інформацію про будову електронної оболонки атома відомостями про кількість енергетичних комірок (кожну комірку позначають квадратиком) та заповнення їх електронами. Два спарені електрони однієї комірки позначають двома протилежно спрямованими стрілками рений електрон — однією.
Графічна електронна формула — це відображення розподілу електронів в електронній оболонці атома за допомогою енергетичних комірок і стрілок.
Приклад графічної електронної формули, де енергетичні комірки зображені об'ємно, наведено на рисунку 1.
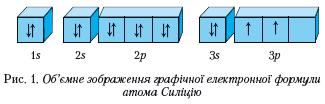
Напишіть електронну й графічну електронну формули хімічних елементів із порядковими номерами 2 і 13. У якого з атомів відсутні неспарені електрони?
Види хімічного зв'язку. Основою теорії хімічного зв'язку є положення про те, що утворення хімічних зв'язків супроводжується досягненням атомами завершеної будови зовнішнього енергетичного рівня.
Зовнішній енергетичний рівень уважається завершеним, якщо він містить 8 електронів (для Гідрогену та Гелію — 2). При утворенні хімічних зв'язків ядра атомів не змінюються; зміни відбуваються лише в електронних оболонках.
Хімічним зв'язком називають взаємодію між атомами, що зумовлює утворення молекул і кристалів.
Ви вже вивчали ковалентний, йонний та водневий зв'язки.
Повторимо утворення ковалентного та йонного зв'язків на прикладі сполук хімічних елементів із порядковими номерами 1, 8, 11, 17.
Спочатку запишемо електронні й графічні електронні формули атомів зазначених елементів:
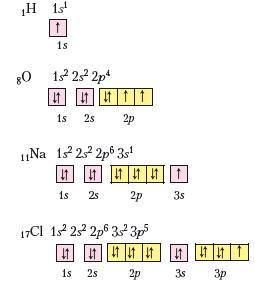
Ви вже знаєте про існування двохатомних молекул простих речовин водню Н2 і кисню О2, молекул води Н2О та речовини не-молекулярної будови натрій хлориду КаСІ. Пригадаємо, яким способом атоми Гідрогену, Оксигену, Хлору та Натрію досягали завершеної будови зовнішнього енергетичного рівня в кожній з цих речовин.
Наявний в атома Гідрогену 1 електрон становить половину від кількості завершеного для нього (двохелектронного) зовнішнього енергетичного рівня. В Оксигену на зовнішньому енергетичному рівні 6 електронів, тобто він близький до завершеного для нього восьмиелектронного складу. Маючи половину й більше половини електронів, аніж їх є на завершеному енергетичному рівні, атомам цих елементів енергетично вигідніше не віддавати електрони, а приєднувати або утворювати спільні електронні пари. Так, у молекулі водню два атоми Гідрогену досягають завершеності зовнішнього енергетичного рівня за рахунок утворення однієї спільної електронної пари, у молекулі кисню — двох (рис. 2).
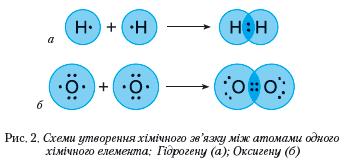
В обох молекулах спільні електронні пари рівновіддалені від ядер атомів, між якими утворився хімічний зв'язок.
У молекулі води атоми також сполучені спільними електронними парами (рис. 3), зміщеними ближче до ядра атома Оксигену.
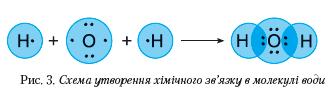
Зміщення електронних пар відбулося тому, що Оксиген, порівняно з Гідрогеном, має більшу електронегативність — умовну величину, яка характеризує здатність атома в сполуці притягувати до себе електрони.
Неметалічні елементи характеризуються високою, порівняно з металічними, електронегативністю, тому між атомами неметалічних елементів хімічний зв'язок утворюється за рахунок спільних електронних пар, а не шляхом віддавання й приєднання електронів.
Хімічний зв'язок за допомогою спільних електронних пар називається ковалентним. Якщо спільні електронні пари рівновіддалені від ядер обох атомів, він — неполярний, а якщо зміщені в бік більш електронегативного атома — полярний.
Напишіть електронну формулу атома Неону. Висловіть припущення про хімічну активність атомів цього хімічного елемента.
Поясніть, який вид ковалентного зв'язку утворюється між атомами: а) Гідрогену і Брому в гідроген броміді НВг; б) між атомами Брому в молекулі брому Вг2.
Натрій хлорид, на відміну від водню, кисню й води, є речовиною немолекулярної будови. Тож утворення хімічного зв'язку відбувається по-іншому. Атом Натрію віддає єдиний електрон зовнішнього енергетичного рівня й перетворюється на катіон, у якого завершений зовнішній енергетичний рівень (ним стає передостанній енергетичний рівень атома Натрію). Тому Хлору енергетично вигідно приєднати цей електрон на зовнішній енергетичний рівень і завершити його. При цьому нейтральні атоми Натрію та Хлору перетворюються на заряджені частинки — йони:
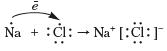
Зв'язок, що утворюється в речовинах за рахунок притягування різнойменно заряджених йонів, називається йонним зв'язком.
Електронейтральні атоми всіх металічних елементів здатні до віддавання, а не до приєднання електронів.
Зробіть висновок про можливість існування аніонів у Гідрогену та металічних елементів.
О. Г. Ярошенко,Хімія, 10 клас
Надаслано читачами інтернет-сайтів
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|