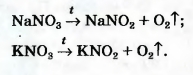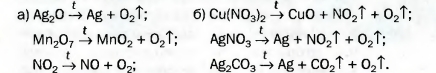|
Гипермаркет знаний>>Химия>>Химия 7 класс>> Получение кислорода
> об открытии кислорода; Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A . Л. Лавуазье исследовал кислород и дал ему название oxygen. Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).
Неисчерпаемым источником кислорода являтся воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет —196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).
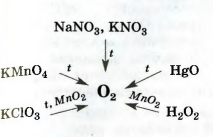
Дж. Пристли получал этот газ из соединения, название которого — меркурий(II) оксид. Ученый использовал стеклянную линзу, с помощью которой фокусировал на веществе солнечный свет. В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий(||) оксид (порошок желтого цвета) превращается в ртуть и кислород. Ртуть выделяется в газообразном состоянии и конденсируется на стенках пробирки в виде серебристых капель. Кислород собирается над водой во второй пробирке. Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании. Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения. Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения: • калий перманганат KMnO4 (бытовое название марганцовка; вещество является распространенным дезинфицирующим средством) • калий хлорат KClO3 (тривиальное название — бертолетова соль, в честь французского химика конца XVIII — начала XIX в. К.-Л. Бертолле) Небольшое количество катализатора — манган (IV) оксида MnO2 — добавляют к калий хлорату для того, чтобы разложение соединения происходило с выделением кислорода1. Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), что бы она едва тлела. Составьте уравнение реакции разложения гидроген пероксида, которым продуктом реакции является вода. В лаборатории кислород можно также получить разложением натрий нитрата NaNO3 или калий нитрата KNO32. Соединения при нагревании сначала плавятся, а затем разлагаются:
2Эти вещества используют в качестве удобрений. Их общее название — селитры. Сведения о том, как получают кислород в лаборатории, собраны в схеме 7. Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
Кислород был открыт в конце XVIII в. несколькими учеными. Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ. 129. Как получают кислород в промышленности? Почему для этого не используют калий перманганат или гидроген пероксид? 130. Какие реакции называют реакциями разложения? 131. Превратите в химические уравнения такие схемы реакций:
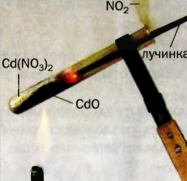
133. На рисунке 55 изображен момент разложения белого твердого вещества, которое имеет формулу Cd(NO3)2. Внимательно рассмотрите рисунок и опишите все, что происходит во время реакции. Почему вспыхивает тлеющая лучинка? Составьте соответствующее химическое уравнение. 134. Массовая доля Оксигена в остатке после нагревания калий нитрата KNO3 составила 40 %. Полностью ли разложилось это соединение? Рис. 55. Разложение вещества при нагревании
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл. Содержание урока Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: