|
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Типы реакционноспособных частиц и механизмы реакций в органической химии.
Наиболее характерная для органических соединений ковалентная связь образуется при перекрывании атомных орбиталей и образовании общих электронных пар. В результате этого образуется общая для двух атомов орбиталь, на которой находится общая пара электронов. При разрыве связи судьба этих общих электронов может быть разной.
Обменный механизм образования ковалентной связи. Гомолитический разрыв связи
Орбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование ковалентной связи по обменному механизму:
Н· + ·Н —> Н : Н, или Н—Н
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам.
Процессом, противоположным образованию ковалентной связи по обменному механизму, является разрыв связи, при котором к каждому атому отходит по одному электрону. В результате этого образуются две незаряженные частицы, имеющие неспаренные электроны:
Такие частицы называются свободными радикалами.
Свободные радикалы — атомы или группы атомов, имеющие неспаренные электроны.
Механизм разрыва ковалентной связи, при котором образуются свободные радикалы, называется гемолитическим или гомолизом (гомо — одинаковый, т. е. такой тип разрыва связи приводит к образованию одинаковых частиц).
Реакции, которые протекают под действием и при участии свободных радикалов, называются свободнорадикальными реакциями.
В курсе неорганической химии вы уже встречались с этими процессами. Это реакции взаимодействия водорода с кислородом, галогенами, реакции горения. Обратите внимание на то, что реакции этого типа отличаются высокой скоростью, выделением большого количества тепла. Причины этих явлений, а также механизм самих реакций, характерных для органических соединений, мы рассмотрим несколько позже.
Донорно-акцепторный механизм образования ковалентной связи. Гетеролитический разрыв связи
Ковалентная связь может образоваться и по донорно-акцептор-ному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается с незаполненной орбиталью другого атома (или катиона), имеющего незаполненную орбиталь, при этом формируется ковалентная связь, например:
Н+ + :O—Н- —> Н—О—Н
акцептор донор
Донорно-акцепторный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неподеленной электронной пары одного атома — донора. Второй атом, акцептор, должен предоставить незаполненную орбиталь.
Способ разрыва ковалентной связи, обратный ее образованию по донорно-акцепторному механизму, — гетеролитический, или ге-теролиз, приводит к образованию положительно и отрицательно заряженных частиц, так как в данном случае оба электрона из общей электронной пары остаются при одном из атомов, у другого атома получается незаполненная орбиталь:
R :| R = R:- + R+
Уже известным нам из курса неорганической химии случаем гетеролиза является электролитическая диссоциация кислот:
Н |: С1 = Н+ + С1:-
Можно легко догадаться, что частица, имеющая неподеленную электронную пару R:- , т. е. отрицательно заряженный ион, будет притягиваться к положительно заряженным атомам или к атомам, на которых существует по крайней мере частичный или эффективный положительный заряд. Частицы с неподеленными электронными парами называют нуклеофилъными агентами (nucleus — ядро, положительно заряженная часть атома), т. е. «друзьями» ядра, положительного заряда.
Нуклеофилы (Nu) — анионы или молекулы, имеющие неподе-ленную пару электронов, взаимодействующие с участками молекул, на которых сосредоточен эффективный положительный заряд.
Примеры нуклеофилов: Сl- (хлорид-анион), ОН- (гидроксид-анион), СН3O- (метоксид-анион), СН3СОО- (ацетат-анион).
Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить ее и, следовательно, будут притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподеленная электронная пара. Они являются электрофилами, «друзьями» электрона, отрицательного заряда или частиц с повышенной электронной плотностью.
Электрофилы — катионы или молекулы, имеющие незаполненную электронную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома.
Не всякая частица с незаполненной орбиталью является электрофилом. Так, например, катионы щелочных металлов имеют конфигурацию инертных газов и не стремятся к приобретению электронов, так как имеют низкое сродство к электрону. Из этого можно сделать вывод, что, несмотря на наличие у них незаполненной орбитали, подобные частицы не будут являться электрофилами.
Взаимное влияние атомов в молекулах органических соединений
Одним из важнейших положений теории строения органических соединений А. М. Бутлерова является положение о том, что свойства атома в молекуле определяются не только его природой, но и его ближайшим окружением.
До того как мы начнем рассматривать механизмы реакций органических соединений, необходимо рассмотреть суть этого взаимного влияния атомов и групп атомов в органических соединениях.
Индуктивный эффект. Рассмотрим распределение электронной плотности в молекуле бромметана СН3Вr. Связь С—Вr в молекуле бромметана полярна. Напомним, что полярность связи определяется электроотрицательностью атомов химических элементов, т. е. их способностью притягивать к себе электроны при образовании химической связи.
Электроотрицательность брома больше, чем углерода, и в результате этого на атоме брома образуется частичный отрицательный заряд Þ-, а на атоме углерода — частичный положительный заряд Þ+. Смещение электронов по связи С—Вr можно показать двумя способами — либо указав частичный заряд на атомах, либо стрелкой вдоль связи.
СНÞ+—ВrÞ- СН3 —> Вr
Смещение электронной плотности о-связи, происходящее вследствие различия электроотрицательностей данного атома и атома влияющей группы, называется индуктивным эффектом (I).
Принято говорить, что атом с большей электроотрицательностью, притягивающей к себе электроны, обладает отрицательным, акцепторным (to accept — принимать) эффектом, который обозначается -I.
К чему же может привести I-эффект брома?
Атом галогена в молекуле галогеналкана (бром в бромметане) легко замещается на гидроксил-анион под действием водного раствора щелочи:
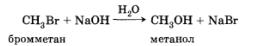
Гидроксил-анион притягивается к атому углерода (атакует атом углерода), на котором сосредоточен частичный положительный заряд, и замещает бром, точнее, бромид-анион.
В молекуле 1-хлорпропана электронная пара в связи С—Сl смещена в сторону атома хлора вследствие его большей электроотрицательности. При этом атом углерода, получивший частичный положительный заряд (§+), оттягивает электроны от связанного с ним атома углерода, тот, в свою очередь, от следующего:
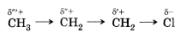
Таким образом, индуктивный эффект передается по цепи, но быстро затухает: он практически не наблюдается уже через три ст-связи.
Рассмотрим другую реакцию — присоединение бромоводорода к этену:
СН2=СН2 + НВr —> СН3—СН2Вr
На начальной стадии этой реакции происходит присоединение катиона водорода к молекуле, содержащей кратную связь:
СН2=СН2 + Н+ —> СН2—СН3
Электроны л-связи сместились к одному атому углерода, на соседнем оказался положительный заряд, незаполненная орбиталь.
Устойчивость подобных частиц определяется тем, насколько хорошо скомпенсирован положительный заряд на атоме углерода. Эта компенсация происходит за счет смещения электронной плотности а-связи в сторону положительно заряженного атома углерода, т. е. положительного индуктивного эффекта (+1).
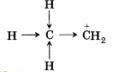
Группа атомов, в данном случае метильная группа, от которой электронная плотность оттягивается, обладает донорным эффектом, который обозначается +1.
Мезомерный эффект. Существует другой способ влияния одних атомов или групп на другие — мезомерный эффект, или эффект сопряжения.
Рассмотрим молекулу бутадиена-1,3:
СН2=СН СН=СН2
Оказывается, что двойные связи в этой молекуле — это не просто две двойные связи! Так как они находятся рядом, происходит перекрывание п-связей, входящих в состав соседних двойных, и образуется общее для всех четырех атомов углерода п-электронное облако. При этом система (молекула) становится более устойчивой. Это явление называется сопряжением (в данном случае п — п-сопряжением).
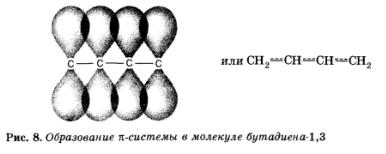
Дополнительное перекрывание, сопряжение л-связей, разделенных одной о-связью, приводит к их «усреднению». Центральная простая связь приобретает частичный «двойной» характер, становится прочнее и короче, а двойные — несколько ослабевают и удлиняются.
Другим примером сопряжения может служить влияние двойной связи на атом, имеющий неподеленную электронную пару.
Так, например, при диссоциации карбоновой кислоты неподеленная электронная пара остается на атоме кислорода:
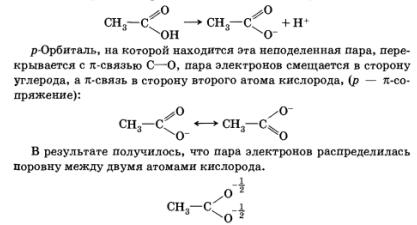
Это приводит к повышению устойчивости образовавшегося при диссоциации аниона, увеличению силы кислоты.
Смещение электронной плотности в сопряженных системах с участием п-связей или неподеленных электронных пар называется мезомерным эффектом (М).
Основные механизмы протекания реакций
Мы выделили три основных типа реагирующих частиц — свободные радикалы, электрофилы, нуклеофилы и три соответствующих им типа механизмов реакций:
• свободнорадикальные;
• электрофильные;
• нуклеофилъные.
Кроме классификации реакций по типу реагирующих частиц, в органической химии различают четыре вида реакций по принципу изменения состава молекул: присоединения, замещения, отщепления, или элиминирования (от англ. to eliminate — удалять, отщеплять), и перегруппировки. Так как присоединение и замещение могут происходить под действием всех трех типов реакционноспо-собных частиц, можно выделить несколько основных механизмов протекания реакций.
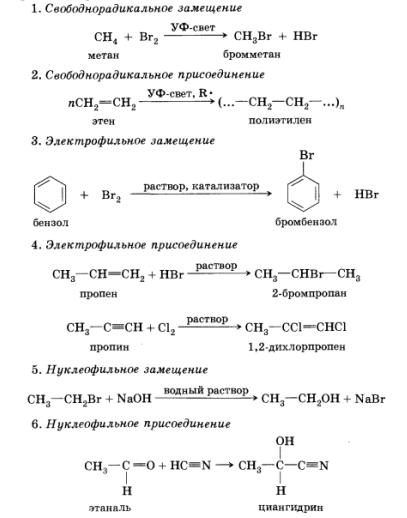
Кроме этого, мы рассмотрим реакции отщепления, или элиминирования, которые идут под воздействием нуклеофильных частиц — оснований.
7. Элиминирование

Можно считать, что в этой реакции происходит отщепление молекулы бромоводорода от молекулы 2-бромэтана. В присутствии щелочи образуется бромид натрия и вода.
1. Что такое гомолитический и гетеролитический разрывы ковалентной связи? Для каких механизмов образования ковалентной связи они характерны?
2. Что называют электрофилами и нуклеофилами? Приведите их примеры.
3. В чем различия между мезомерным и индуктивным эффектами? Как эти явления иллюстрируют положение теории строения органических соединений А. М. Бутлерова о взаимном влиянии атомов в молекулах органических веществ?
4. В свете представлений об индуктивном и мезомерном эффектах рассмотрите взаимное влияние атомов в молекулах:
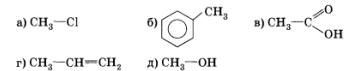
Подтвердите свои выводы примерами уравнений химических реакций.
рефераты для 10 класса, ответы на вопросы по химии, идеальные уроки
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
















