|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Швидкість хімічної реакції, залежність швидкості реакції від різних чинників
ШВИДКІСТЬ ХІМІЧНОЇ РЕАКЦІЇ, ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ ВІД РІЗНИХ ЧИННИКІВ
Швидкість хімічної реакції, залежність швидкості реакції від різних чинників
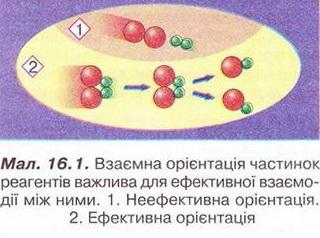
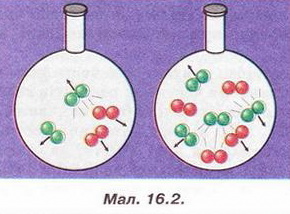
• Швидкість хімічної реакції - швидкість, з якою утворюються її продукти або витрачаються реагенти. Вивчаючи хімію та спостерігаючи явища повсякденного життя, ви неодноразово пересвідчувалися, що хімічні реакції відбуваються з різною швидкістю (наведіть кілька прикладів). Завдання Розташуйте явища за зростанням швидкості хімічних реакцій, які їх супроводжують: Чому одні хімічні реакції відбуваються миттєво, а інші тривають століттями? Відповідь на це запитання важливо знати для того, аби керувати швидкістю хімічних перетворень, прискорювати корисні й уповільнювати шкідливі процеси. Аби розпочалася хімічна реакція, потрібен контакт між частинками реагуючих речовин. Проте не кожне зіткнення частинок реагентів веде утворення продуктів реакції. Якби кожне зіткнення було активним, будь-яка реакція відбувалася б миттєво. Щоб під час зіткнення частинок реагентів зруйнувалися старі і утворилися нові хімічні зв'язки, енергія цих частинок має сягнути певної мінімальної величини (або перевищити її). Цю величину називають енергією активації. Поняття енергії активації ввів Сванте Арреніус у 1889 р. Аби розпочалася хімічна реакція, частинки реагентів мають подолати активаційний енергетичний бар'єр. Цьому сприяє нагрівання, світлове, мікрохвильове та радіаційне опромінення реагентів. Частинки реагентів, запас енергії яких не менший за енергію активації, - це так звані активні частинки. Чим менша енергія активації, тим більша кількість частинок із запасом енергії, необхідної для ефективної взаємодії. Такі реакції відбуваються миттєво. За високих значень енергії активації хімічна реакція відбувається повільно. Важливим чинником, особливо для багатоатомних молекул складної форми, є їхня взаємна орієнтація (мал. 16.1). Ви, звичайно, пам'ятаєте, що швидкість хімічної реакції можна збільшити, використовуючи каталізатор. Він змінює механізм реакції, спрямовуючи її перебіг шляхом з нижчим значенням енергії активації! Від яких ще чинників залежить швидкість хімічної реакції? • Природа реагуючих речовин істотно позначається на їхній реакційній здатності. Дослідімо, приміром, реакції різних металів - цинку, магнію та заліза з хлоридною кислотою. Помістімо у хімічні стакани ошурки цих металів кількістю 0,1 моль кожний і добавмо однакові порції хлоридної кислоти. Про швидкість перебігу кожної з реакцій можна судити за інтенсивністю виділення бульбашок водню. Найшвидше з хлоридною кислотою реагує магній, найповільніше - залізо. Завдання 1. Обчисліть маси порцій металів, узятих для проведення реакції. 2. Визначте чи узгоджуються результати досліду з положенням цих металів у ряду активності (с. 105, мал. 14.4). 3. Запишіть рівняння хімічних реакцій, розгляньте їх з точки зору окиснення-відновлення та електролітичної дисоціації. Отже, природа металів впливає на швидкість відновлення ними катіонів Гідрогену в розчині. Різна реакційна здатність металів зумовлена особливостями електронної конфігурації їхніх атомів, внутрішньою будовою тощо. • Концентрація реагентів також впливає на швидкість хімічної реакції. Якщо виконати описаний дослід з хлоридною кислотою, розбавленою вдвічі, усі реакції відбуватимуться повільніше. Адже зі зменшенням концентрації реагентів зменшуватиметься частота зіткнень (у тому числі й активних) між їхніми частинками. Зі збільшенням концентрації реагентів зростає кількість зіткнень (активних також) між їхніми частинками (мал. 16.2). Збільшення концентрації кисню інтенсифікує горіння. Виявляючи тліючою скіпкою кисень у посудині, ви також пересвідчилися, що збільшення його концентрації (порівняно з умістом в повітрі) істотно пришвидшує реакцію горіння. Завдання Поясніть, чому: а) не можна під час пожежі прочиняти вікна та двері; б) застосування кисневого дуття інтенсифікує згоряння палива. Зі зростанням тиску швидкість реакції за участю газуватих речовин зростає, бо вміст активних молекул газу в одиниці об'єму (концентрація) збільшується. • Температура, за якої відбувається хімічна реакція, також позначається на її швидкості. Зі зростанням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній суміші. Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти довше зберігаються за низьких температур. • Площа поверхні контакту реагентів - ще один чинник, від якого залежить швидкість хімічної реакції. Подрібнення та розпорошення речовин зумовлює збільшення ймовірності стикання активних частинок взаємодіючих речовин. Тонкодисперсний жовтий пилок спор плауна (лікоподій) застосовують у фармації для пересипання пігулок. Купку цієї речовини не завжди вдається підпалити сірником. Натомість розподілений у повітрі лікоподій згоряє миттєво. Завдання Поясніть, чому вугільний пил, на відміну від шматків вугілля, вибухонебезпечний. Аби остаточно пересвідчитися в тому, як впливають різні чинники на швидкість хімічних реакцій, виконайте лабораторні досліди. ЛАБОРАТОРНІ ДОСЛІДИ Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ Обладнання: пробірки у штативі, пластина із заглибинами, пробіркотримач, пальник. Реактиви: дистильована вода; цинк (гранули й дрібні ошурки), хлоридна кислота. Завдання Примітка: завдання, позначені *, не є обов'язковими до виконання. Зробіть узагальнювальний висновок про вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічних реакцій. № 5(а). Вплив концентрації на швидкість реакції цинку з хлоридною кислотою Інструкція Помістіть у дві пробірки або заглибини пластини по гранулі цинку. В одну місткість налийте дистильованої води стільки» щоб покрити гранулу цинку наполовину. Долийте в обидві місткості хлоридної кислоти стільки, щоб вкрити поверхню цинку. Що спостерігаєте? Де інтенсивніше виділяються бульбашки? Зробіть висновок про вплив концентрації хлоридної кислоти на швидкість реакції між нею і цинком. № 5(6). Вплив температури на швидкість реакції цинку з хлоридною кислотою Інструкція Помістіть у дві пробірки по гранулі цинку. Долийте хлоридної кислоти стільки, щоб вкрити поверхню цинку. Нагрійте реагенти в одній з пробірок. Що спостерігаєте? Де інтенсивніше виділяються бульбашки? Зробіть висновок про вплив температури на швидкість реакції цинку з хлоридною кислотою. №5(в). Вплив площі поверхні контакту реагентів на швидкість реакції цинку з хлоридною кислотою Інструкція Помістіть у дві пробірки (або заглибини пластини) гранулу цинку й дрібні цинкові ошурки. Долийте хлоридної кислоти стільки, аби покрити поверхню цинку. Що спостерігаєте? Де інтенсивніше виділяються бульбашки водню - у місткості з гранулою чи з ошурками цинку? Зробіть висновок про вплив площі поверхні контакту реагентів на швидкість реакції цинку з хлоридною кислотою. Уявлення про швидкість хімічної реакції стануть вам у пригоді й у повсякденному житті, й під час вивчення наступного параграфа. Стисло про головне Хімічні реакції відбуваються з різною швидкістю. Швидкість хімічної реакції - поняття, яке характеризує швидкість утворення її продуктів або витрати реагентів. Аби пришвидшувати корисні й уповільнювати шкідливі процеси, важливо знати чинники, які впливають на швидкість хімічних реакцій. Енергія активації - запас енергії, необхідний для того, щоб під час зіткнення частинок реагентів зруйнувалися старі й утворилися нові хімічні зв'язки. Взаємна орієнтація у просторі (особливо для багатоатомних молекул складної форми) також впливає на ефективність зіткнень частинок реагентів. Каталізатор змінює механізм реакції, спрямовуючи її перебіг шляхом з нижчим значенням енергії активації, тому швидкість реакції зростає. Природа реагуючих речовин істотно позначається на їхній реакційній платності. Відмінність у ній зумовлена особливостями електронної конфігурації атомів, будовою речовин тощо. Зі збільшенням концентрації реагентів зростає швидкість хімічної реакції між ними. Тому зі збільшенням тиску швидкість реакції за участю газуватих речовин зростає, бо вміст активних молекул газу в одиниці об'єму (концентрація) збільшується. Зі зростанням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній суміші. Подрібнення та розпорошення речовин також сприяє збільшенню ймовірності стикання активних частинок реагентів і, відповідно, зростанню швидкості взаємодії між жими. Застосуйте свої знання й уміння 1. Назвіть чинники, які впливають на швидкість хімічних реакцій. 2. Наведіть приклади хімічних реакцій, які відбуваються з різною швидкістю. 3. Поясніть, що таке енергія активації. 4. Визначте пропущене слово в уривку з науково-популярної статті про чинники, які впливають на швидкість хімічних реакцій: «...подібний до інструктора-провідника, який веде альпіністів через гірський хребет. Він проводить одну групу через перевал і потім вертається за наступною. Шлях через перевал проходить значно нижче шляху через вершину, і група робить перехід швидше, ніж без провідника. Можливо навіть, що самостійно група взагалі не змогла б подолати хребет». 5. Реакція розкладання амоній дихромату та термітний процес - екзотермічні. Поясніть, чому для початку їхнього перебігу потрібне нагрівання. 6. Олесь побував на роботі у свого батька, який працює в науково-дослідному інституті й синтезує органічні сполуки. Хлопець розповів однокласникам, що деякі з реакцій батько виконує в звичайній мікрохвильовій пічці. Оцініть вірогідність Олесєвої розповіді - чи не пожартував він часом? Аргументуйте свою думку. 7. З огляду на вивчене встановіть відповідність позицій двох переліків:
8. Для дослідження реакції цинку з кислотою Петро взяв хлоридну кислоту а Галина - оцтову такої самої концентрації. Спрогнозуйте, у якому випадку реакція відбуватиметься швидше. 9. Проаналізуйте зміст третьої колонки таблиці 13.1 й визначте, про що ви дізналися і чого навчилися, опрацювавши § 16. Скарбничка досвіду Виконайте досліди й підготуйте презентацію за результатами свого дослідження. Завдання 1. У два пластикові стакани налийте води об'ємом 50 мл і розчиніть по чайній ложці питної соди. У два інших стакани помістіть лимонну кислоту: в перший об’ємом із сірникову головку, в другий - приблизно в 5 разів більше. Налийте в обидва стакани порції води об'ємом 10 мл і, перемішуючи, розчиніть кислоту В обидва стакани з розчинами лимонної кислоти одночасно долийте попередньо виготовлені порції розчину натрій гідрогенкарбонату. Що спостерігаєте? Де інтенсивніше виділяються бульбашки? Зробіть висновок про вплив концентрації лимонної кислоти на швидкість реакції між нею й питною содою. Завдання 2. У дві скляні посудини помістіть лимонну кислоту: в першу - чверть чайної ложки, в другу - одну чайну ложку. Налийте в обидві посудини води об’ємом 100 мл і, перемішуючи, розчиніть кислоту. В обидві посудини з розчинами лимонної кислоти одночасно помістіть сирі курячі яйця. Що спостерігаєте? Де інтенсивніше виділяються бульбашки? Зробіть висновок про вплив концентрації лимонної кислоти на швидкість реакції між нею й кальцій карбонатом у складі шкаралупи.
Оборотні й необоротні реакції
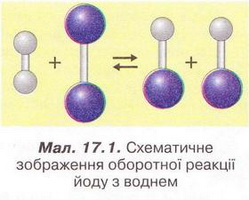
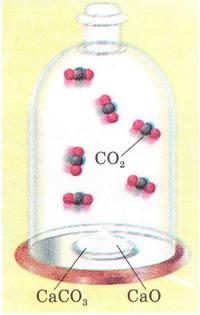
• Оборотні й необоротні реакції певною мірою відомі вам з теми «Розчини». Ви, звичайно, пам'ятаєте, що умовами перебігу до кінця (необоротності) реакцій обміну між електролітами в розчині є утворення осаду води чи виділення газу: ВаСl2 + Nа2S04 → ВаS04 + NаСІ Завдання Перетворіть наведені схеми реакцій на хімічні рівняння, запишіть їх у повній і скороченій йонних формах. Необоротні реакції відбуваються тільки в одному напрямі аж до повної витрати одного з реагентів. Реакція горіння магнію (мал. 13.3), приміром, необоротна. Вона триватиме доти, доки не витратиться весь магній або (якщо реакція відбувається у закритій системі) кисень, який підтримує горіння. Натомість оборотні реакції відбуваються одночасно у двох протилежних напрямах - прямому і зворотному (мал. 17.1): Н2 + І2= 2HI Гідроген йодид - продукт взаємодії йоду з воднем - легко розкладається - відбувається обернена реакція. Швидкість прямої реакції спочатку максимальна. Згодом вона зменшується, бо поступово зменшуються концентрації водню та йоду. Натомість зростає швидкість оберненої реакції - адже концентрація гідроген йодиду в реакційному середовищі збільшується. Через певний час після початку реакції встановлюється динамічна рівновага між цими двома процесами пригадайте модель, описану в завданні 8 § 5). Це означає, що пряма і обернена реакції відбуваються з однаковими швидкостями. Тому в реакційній суміші наявні всі учасники реакції: водень, йод і гідроген йодид. Отже, реакція необоротна, якщо в реакційній суміші після завершення процесу не можна виявити хоча б один з реагентів. Реакція оборотна, якщо після встановлення рівноваги у реакційній суміші наявні всі учасники реакції - і реагенти, і продукти. Розгляньмо реакцію термічного розкладу кальцій карбонату. У промисловості її використовують для добування негашеного вапна з вапняку: CaCO3(т) →CaO(т) + CO2(г)↑; ΔH > 0 Якщо реакція відбувається у відкритій системі, то газуватий карбон(ІV) окcид необоротно залишає сферу реакції. За таких умов реакція відбувається аж до і повної витрати кальцій карбонату. Натомість у закритій системі (мал. 17.2) встановлюється рівновага: CaCO3(т) ⇔CaO(т) +СO2(г)↑; ΔH > 0 Тобто одночасно відбуваються два процеси: прямий і обернений. Зверніть увагу: пряма реакція ендотермічна, а обернена - екзотермічна. Кількість теплоти, яка витрачається на розкладання кальцій карбонату, дорівнює кількості теплоти, яка виділяється внаслідок реакції між відповідними оксидами. Очевидно, що хімічною рівновагою можна керувати, використовуючи чинники, які впливають на швидкість хімічної реакції. Збільшення концентрації реагентів: приятиме збільшенню швидкості прямої реакції. Унаслідок її перебігу збільшиться концентрація продуктів, тобто обернена реакція також прискориться. Аби зменшити швидкість оберненої реакції, треба вилучати із системи продукти прямої реакції. Мал.17.2. 'У закритій системі реакція термічного розкладу кальцій карбонату оборотна. У реакційній суміші наявні всі учасники реакції: кальцій карбонат, кальцій оксид і карбон (IV) оксид. Отже, чи є реакція оборотною, залежить від умов її перебігу. Змінюючи концентрації реагентів і продуктів, температуру, а для деяких реакцій - тиск, можна досягти зміщення хімічної рівноваги в потрібному напрямі. Це має неабияке практичне значення, оскільки виробництво сульфатної кислоти, амоніаку, багатьох інших неорганічних і органічних речовин пов'язане з оборотними процесами. Докладніше про це ви дізнаєтеся у старшій школі, обравши відповідний профіль навчання. Стисло про головне Умовами перебігу до кінця (необоротності) реакцій обміну між електролітами в розчині є утворення осаду, води чи виділення газу. Необоротні реакції відбуваються тільки в одному напрямі аж до повної витрати одного з реагентів. Натомість оборотні реакції відбуваються одночасно у двох протилежних напрямах - прямому і зворотному. У рівняннях оборотних хімічних реакцій замість знака « = » використовують знак який указує на одночасний перебіг двох протилежних за напрямами реакцій - прямої (→) і оберненої (<--). Реакція необоротна, якщо в реакційній суміші після завершення процесу не можна виявити хоча б один з реагентів. Реакція оборотна, якщо після встановлення рівноваги в реакційній суміші наявні всі учасники реакції - і реагенти, і продукти. Хімічною рівновагою можна керувати, використовуючи чинники, які впливають на швидкість хімічної реакції. Це має неабияке практичне значення. Застосуйте свої знання й уміння 1. Назвіть умови перебігу до кінця реакцій обміну між електролітами в розчині. 2. Наведіть приклади реакцій обміну між електролітами у розчині, які відбуваються до кінця. Запишіть рівняння реакцій в повній і скороченій йонних формах. 3. Поясніть, які реакції називають: а) необоротними; б) оборотними. 4. Виберіть необоротні процеси: 5. У виробництві сульфатної кислоти використовують реакцію 2S02 + 02 ⇔ 2S03; ΔН < 0. Запишіть рівняння оберненої реакції, класифікуйте її за тепловим ефектом, кількістю і складом реагентів і продуктів та зміною ступенів окиснення. 6. Художник, ілюструючи підручник хімії для дев'ятикласників, зобразив модель динамічної рівноваги (мал. 17.3). Поясніть, якою має бути швидкість руху риби (1) порівняно зі швидкістю течії (2), щоб модель правильно відбивала зміст поняття. Оцініть правильність виконання завдання, аргументуйте свою думку. 7. Проаналізуйте зміст третьої колонки таблиці 13.1 й визначте, про що ви дізналися і чого навчилися, опрацювавши § 17. Г. А. Лашевська, Хімія, 9 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: