|
|
|
| (4 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Молярна маса''' <metakeywords>Хімія, клас, урок, на Тему, Молярна маса</metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Молярна маса''' <metakeywords>Хімія, клас, урок, на Тему, Молярна маса</metakeywords> |
| - | <br> | + | |
| - | Тут буде текст
| + | <br>Між [[Гумор:_Тіла._Характеристики_тіла:_довжина,_маса,_об’єм,_густина|масою]] m і [[3._Кількість_речовини._Моль_—_одиниця_кількості_речовини._Число_Авогадро|кількістю речовини]] v існує певний зв'язок. Щоб його виразити, скористаємося поняттям [[Молярна_маса._Повні_уроки|молярна маса]] (позначається М). <br>Молярна маса — це [[Презентація_на_тему_«Фізичні_величини.Вимірювання_фізичних_величин»|фізична величина]], що дорівнює відношенню маси речовини до відповідної кількості речовини.<br>M = m/v.<br><br>Одиниця молярної маси — кілограм на моль (кг/моль) або грам на моль (г/моль). Виходить, що маса 1 моль речовини і є її молярною масою<br><br>Числове значення молярної маси дорівнює [[Атомна_одиниця_маси._Відносна_атомна_маса_хімічних_елементів|відносній атомній]] або [[Відносна_молекулярна_маса_речовини,_її_обчислення_за_хiмічною_формулою|відносній молекулярній (формульній) масі]] речовини. Наприклад, потрібно з'ясувати, яка молярна маса кисню. Оскільки М<sub>r</sub>(0<sub>2</sub>) = 32, то<br>М(0<sub>2</sub>) = (32 г)/(1 моль) = 32 г/моль.<br><br>А яка молярна маса заліза? <br>A<sub>r</sub>(Fe) = 56; <br>M(Fe) = 56 г/моль.<br><br>Молярну масу складної речовини можна обчислити, виходячи з молярних мас хімічних елементів, які входять до її складу, наприклад:<br>M<sub>r</sub>(H<sub>2</sub>S0<sub>4</sub>) = 1 • 2 + 32 + 16 • 4 = 98;<br>M(H<sub>2</sub>S0<sub>4</sub>) = 98 г/моль.<br>m(1 моль H<sub>2</sub>S0<sub>4</sub>) = 98 г, тобто 98 г сульфатної кислоти H<sub>2</sub>S0<sub>4</sub> — це її маса, що відповідає кількості речовини 1 моль.<br><br>Отже, молярна маса — це стала характеристика кожної окремої речовини. Вона виражає залежність між масою і кількістю речовини, а тому дає змогу визначати одну величину за відомою іншою, наприклад масу за кількістю речовини і навпаки, кількість речовини за масою:<br>m = M • v (г); v = m/M (моль)<br>m = M (г/моль) • v (моль) = Mv(r); <br>v = m(г) : М (г/моль) = m/M (моль).<br><br>Приклад 1. Яка маса відповідає магній оксиду MgO кількістю речовини 6 моль?<br>Дано:<br>v(MgO) = 6 моль <br>m(MgO) — ?<br>Розв'язування: <br>m = M • v;<br>M(MgO) = 24 + 16 = 40 г/моль; <br>m(MgO) = 40 г/моль • 6 моль = 240 г.<br>Відповідь. Кількості речовини магній оксиду MgO 6 моль відповідає його маса, що дорівнює 240 г.<br><br><br>Приклад 2. Яка кількість речовини ортофосфатної кислоти Н<sub>3</sub>Р0<sub>4</sub> відповідає її масі 392 г?<br>Дано:<br>m(Н<sub>3</sub>Р0<sub>4</sub>) = 392 г <br>v(Н<sub>3</sub>Р0<sub>4</sub>) — ?<br>Розв'язування: <br>v = m/M;<br>М(Н<sub>3</sub>Р0<sub>4</sub>) =1 • 3 + 31 + 16 • 4 = 98 г/моль;<br>v (Н<sub>3</sub>Р0<sub>4</sub>) = (392 г)/(98 г/моль) = 4 моль<br>Відповідь. Ортофосфатній кислоті масою 392 г відповідає кількість речовини 4 моль.<br><br>Поняття «молярна маса» можна використати і для обчислення масової частки елемента в речовині за формулою: |
| | + | |
| | + | [[Image:Молярна маса.jpg|формула. фото]] |
| | | | |
| | <br> | | <br> |
| - | <sub>Безкоштовні підручники по всім предметам безкоштовно, уроки хімії 8 клас онлайн, конспекти уроків</sub> | + | |
| - | <br> | + | Приклад 3. Обчислити масові частки елементів у сульфур(VI) оксиді S0<sub>3</sub>.<br>Розв'язування.<br>M(S0<sub>3</sub>) = 32 + 16 • 3 = 80 г/моль;<br>W(S) = (32 г/моль)/(80 г/моль) = 0,4 або 40 %.<br>W(0) = 100 % - 40 % = 60 %.<br>Відповідь. Масова частка Сульфуру в його оксиді становить 40 %, а Оксигену — 60 %.<br><br>Поняття «молярна маса» використовується й тоді, коли хімічну формулу речовини встановлюють на підставі експериментальних даних.<br><br><br>Приклад 4. Зразок хімічної сполуки масою 2,61 г містить 1,65 г Цинку та 0,96 г Сульфуру. Яка формула цієї сполуки?<br><br>Дано:<br>m(ZnxSy) = 3,01 г <br>m(Zn) = 1,65 г <br>m(S) = 0,96 г<br>ZnxSy — ?<br>Розв'язування: <br>Знайди відношення кількості речовини Цинку до кількості речовини Сульфуру за формулою:<br>v = m/M<br>За періодичною системою Д. І. Менделєєва визнач молярні маси елементів:<br>M(Zn) = 65 г/моль; M(S) = 32 г/моль. Знайди кількість речовини Zn і S у зразку:<br>v(Zn) = (1,65 г)/(65 г/моль) = 0,03 моль; <br>v(S) = (0,96 г)/(32 г/моль) = 0,03 моль. <br>Відношення знайдених величин становить (Zn) : (S) = = 0,03 : 0,03 моль = 1 моль : 1 моль.<br>Отже, на один моль атомів Цинку в сполуці припадає один моль атомів Сульфуру.<br>Відповідь. Формула сполуки ZnS — цинк сульфід.<br><br><br>'''Висновки'''<br>Молярна маса — це маса 1 моль речовини. Молярна маса чисельно дорівнює формульній масі речовини. Одиницями молярної маси є кілограм на моль (кг/ моль) або грам на моль (г/моль).<br>Молярна маса виражає залежність між масою і кількістю речовини: масу можна визначити за кількістю речовини і, навпаки, кількість речовини за масою:<br>m = M • v; <br>v = m/M.<br><br><br>'''Завдання для самоконтролю'''<br>''1. Зважили 2,7 г алюмінію. Якій кількості речовини відповідає дана порція алюмінію?<br>2. Для реакції потрібно взяти сірку й цинк кількістю речовини по 0,5 моль. Яку масу кожної з речовин потрібно зважити?<br>3. Обчисли, яку кількість речовини становить метан СН<sub>4</sub> масоюі г.<br>4. Столова ложка вміщує 18 г води. У склянку налили три столові ложки води. Скільки молекул води міститься в склянці?'' |
| | + | |
| | + | <br>'''Додаткові завдання'''<br>''5. Як показав аналіз, зразок хімічної сполуки масою 160 г містить 128 г Купруму і 32 г Оксигену. Знайди формулу сполуки.<br>6. Обчисли масу 15•10<sup>23</sup> молекул кисню.<br>7. Яку кількість речовини натрій хлориду NaCI містить пачка кухонної солі масою 1 кг?<br>8*. Визнач масу руди, в якій масова частка домішок становить 30 %, що необхідна для добування заліза масою 50 т.<br>9*. Зразок хімічної сполуки масою 32,5 г містить 21,3 г Хлору, решта припадає на Ферум. Визнач формулу цієї сполуки і зазнач її назву.<br>10*. Виведи формулу сполуки Сульфуру з Оксигеном, якщо масові частки елементів становлять, відповідно, по 50 %. Зазнач назву сполуки.''<br> |
| | + | |
| | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту.'' |
| | + | |
| | + | <br> <sub>Безкоштовні підручники по всім предметам, уроки [[Хімія 8 клас|хімії]] 8 клас онлайн, конспекти [[Гіпермаркет Знань - перший в світі!|уроків]]</sub> <br> |
| | + | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 12:44, 16 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Молярна маса
Між масою m і кількістю речовини v існує певний зв'язок. Щоб його виразити, скористаємося поняттям молярна маса (позначається М).
Молярна маса — це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини.
M = m/v.
Одиниця молярної маси — кілограм на моль (кг/моль) або грам на моль (г/моль). Виходить, що маса 1 моль речовини і є її молярною масою
Числове значення молярної маси дорівнює відносній атомній або відносній молекулярній (формульній) масі речовини. Наприклад, потрібно з'ясувати, яка молярна маса кисню. Оскільки Мr(02) = 32, то
М(02) = (32 г)/(1 моль) = 32 г/моль.
А яка молярна маса заліза?
Ar(Fe) = 56;
M(Fe) = 56 г/моль.
Молярну масу складної речовини можна обчислити, виходячи з молярних мас хімічних елементів, які входять до її складу, наприклад:
Mr(H2S04) = 1 • 2 + 32 + 16 • 4 = 98;
M(H2S04) = 98 г/моль.
m(1 моль H2S04) = 98 г, тобто 98 г сульфатної кислоти H2S04 — це її маса, що відповідає кількості речовини 1 моль.
Отже, молярна маса — це стала характеристика кожної окремої речовини. Вона виражає залежність між масою і кількістю речовини, а тому дає змогу визначати одну величину за відомою іншою, наприклад масу за кількістю речовини і навпаки, кількість речовини за масою:
m = M • v (г); v = m/M (моль)
m = M (г/моль) • v (моль) = Mv(r);
v = m(г) : М (г/моль) = m/M (моль).
Приклад 1. Яка маса відповідає магній оксиду MgO кількістю речовини 6 моль?
Дано:
v(MgO) = 6 моль
m(MgO) — ?
Розв'язування:
m = M • v;
M(MgO) = 24 + 16 = 40 г/моль;
m(MgO) = 40 г/моль • 6 моль = 240 г.
Відповідь. Кількості речовини магній оксиду MgO 6 моль відповідає його маса, що дорівнює 240 г.
Приклад 2. Яка кількість речовини ортофосфатної кислоти Н3Р04 відповідає її масі 392 г?
Дано:
m(Н3Р04) = 392 г
v(Н3Р04) — ?
Розв'язування:
v = m/M;
М(Н3Р04) =1 • 3 + 31 + 16 • 4 = 98 г/моль;
v (Н3Р04) = (392 г)/(98 г/моль) = 4 моль
Відповідь. Ортофосфатній кислоті масою 392 г відповідає кількість речовини 4 моль.
Поняття «молярна маса» можна використати і для обчислення масової частки елемента в речовині за формулою:
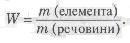
Приклад 3. Обчислити масові частки елементів у сульфур(VI) оксиді S03.
Розв'язування.
M(S03) = 32 + 16 • 3 = 80 г/моль;
W(S) = (32 г/моль)/(80 г/моль) = 0,4 або 40 %.
W(0) = 100 % - 40 % = 60 %.
Відповідь. Масова частка Сульфуру в його оксиді становить 40 %, а Оксигену — 60 %.
Поняття «молярна маса» використовується й тоді, коли хімічну формулу речовини встановлюють на підставі експериментальних даних.
Приклад 4. Зразок хімічної сполуки масою 2,61 г містить 1,65 г Цинку та 0,96 г Сульфуру. Яка формула цієї сполуки?
Дано:
m(ZnxSy) = 3,01 г
m(Zn) = 1,65 г
m(S) = 0,96 г
ZnxSy — ?
Розв'язування:
Знайди відношення кількості речовини Цинку до кількості речовини Сульфуру за формулою:
v = m/M
За періодичною системою Д. І. Менделєєва визнач молярні маси елементів:
M(Zn) = 65 г/моль; M(S) = 32 г/моль. Знайди кількість речовини Zn і S у зразку:
v(Zn) = (1,65 г)/(65 г/моль) = 0,03 моль;
v(S) = (0,96 г)/(32 г/моль) = 0,03 моль.
Відношення знайдених величин становить (Zn) : (S) = = 0,03 : 0,03 моль = 1 моль : 1 моль.
Отже, на один моль атомів Цинку в сполуці припадає один моль атомів Сульфуру.
Відповідь. Формула сполуки ZnS — цинк сульфід.
Висновки
Молярна маса — це маса 1 моль речовини. Молярна маса чисельно дорівнює формульній масі речовини. Одиницями молярної маси є кілограм на моль (кг/ моль) або грам на моль (г/моль).
Молярна маса виражає залежність між масою і кількістю речовини: масу можна визначити за кількістю речовини і, навпаки, кількість речовини за масою:
m = M • v;
v = m/M.
Завдання для самоконтролю
1. Зважили 2,7 г алюмінію. Якій кількості речовини відповідає дана порція алюмінію?
2. Для реакції потрібно взяти сірку й цинк кількістю речовини по 0,5 моль. Яку масу кожної з речовин потрібно зважити?
3. Обчисли, яку кількість речовини становить метан СН4 масоюі г.
4. Столова ложка вміщує 18 г води. У склянку налили три столові ложки води. Скільки молекул води міститься в склянці?
Додаткові завдання
5. Як показав аналіз, зразок хімічної сполуки масою 160 г містить 128 г Купруму і 32 г Оксигену. Знайди формулу сполуки.
6. Обчисли масу 15•1023 молекул кисню.
7. Яку кількість речовини натрій хлориду NaCI містить пачка кухонної солі масою 1 кг?
8*. Визнач масу руди, в якій масова частка домішок становить 30 %, що необхідна для добування заліза масою 50 т.
9*. Зразок хімічної сполуки масою 32,5 г містить 21,3 г Хлору, решта припадає на Ферум. Визнач формулу цієї сполуки і зазнач її назву.
10*. Виведи формулу сполуки Сульфуру з Оксигеном, якщо масові частки елементів становлять, відповідно, по 50 %. Зазнач назву сполуки.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту.
Безкоштовні підручники по всім предметам, уроки хімії 8 клас онлайн, конспекти уроків
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|










