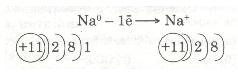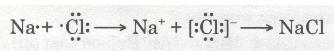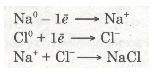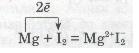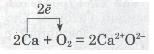|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Йонний зв’язок''' <metakeywords>Хімія, клас, урок, на Тему, Йонний зв’язок</metakeywords> <br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Йонний зв’язок''' <metakeywords>Хімія, клас, урок, на Тему, Йонний зв’язок</metakeywords> <br> |
| | | | |
| - | <u></u><br> | + | <u></u><br><u></u> |
| | | | |
| - | <u></u><br> | + | Ти вже розумієш, як взаємодіють між собою [[Багатоманітність_речовин._Прості_й_складні_речовини._Метали_й_неметали|неметали]]: між їх [[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи|атомами ]]встановлюється [[58._Ковалентний_зв’язок,_його_види._Утворення_ковалентного_неполярного_зв’язку._Утворення_ковалентного_полярного_зв’язку|ковалентний зв'язок]]. А тепер розглянемо, як взаємодіють неметали з [[Відео_до_уроку:_Багатоманітність_речовин._Прості_й_складні_речовини._Метали_й_неметали|металами]]. Атоми цих елементів дуже відрізняються за своєю [[57._Поняття_про_електронегативність_елементів|електронегативністю]], тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:<br>2Na + Сl<sub>2</sub> = 2NaCl |
| | | | |
| - | <u>Тобі треба<br>розуміти суть понять:</u> йонний зв'язок; йон; <br><u>уміти:</u> пояснювати утворення йонного зв'язку в сполуках; характеризувати особливості йонного зв'язку.<br><br><br>Ти вже розумієш, як взаємодіють між собою неметали: між їх атомами встановлюється ковалентний зв'язок. А тепер розглянемо, як взаємодіють неметали з металами. Атоми цих елементів дуже відрізняються за своєю електронегатив-ністю, тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:<br>2Na + Сl<sub>2</sub> = 2NaCl
| + | [[Image:Na + Сl.jpg|формула. фото]] |
| - | | + | |
| - | [[Image:Na + Сl.jpg]] | + | |
| | | | |
| | Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:<br> | | Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:<br> |
| | | | |
| - | [[Image:Атом Натрію.jpg]]<br> | + | [[Image:Атом Натрію.jpg|формула. фото]]<br> |
| | | | |
| - | <br>Передостанній енергетичний рівень з восьми електронів стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.<br>Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон: | + | <br>Передостанній енергетичний рівень з восьми [[Будова_атома._Електрон._Йон._Повні_уроки|електронів]] стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.<br>Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон: |
| | | | |
| - | [[Image:Атом Хлору.jpg]] | + | [[Image:Атом Хлору.jpg|формула. фото]] |
| | | | |
| | <br>Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:<br> | | <br>Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:<br> |
| | | | |
| - | [[Image:Валентний електрон атома Натрію під час взаємодії з атомом Хлору.jpg]] | + | [[Image:Валентний електрон атома Натрію під час взаємодії з атомом Хлору.jpg|формула. фото]] |
| | | | |
| | <br>Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.<br>Різнойменно заряджені йони Натрію Na<sup>+</sup> і Хлору Сl<sup>-</sup>, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:<br> | | <br>Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.<br>Різнойменно заряджені йони Натрію Na<sup>+</sup> і Хлору Сl<sup>-</sup>, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:<br> |
| | | | |
| - | [[Image:Натрій хлорид NaCl.jpg]]<br> | + | [[Image:Натрій хлорид NaCl.jpg|формула. фото]]<br> |
| | + | |
| | + | <br>[[Хімічний_зв’язок_і_будова_речовин|Хімічний зв'язок]], утворений за допомогою взаємодії йонів, називають '''''[[Тема_24._Йонний_зв’язок|йонним зв'язком]]'''''.<br>Речовини, що складаються з [[Ілюстрації_до_теми_«Будова_атома._Електрон._Йон»|йонів]], називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.<br>Приклади речовин з йонним типом хімічного зв 'язку:<br>NaCl, NaBr, NaF, MgCl<sub>2</sub>, MgS, NaOH, Li<sub>2</sub>O, Ca<sub>3</sub>P<sub>2</sub>, AlCl<sub>3</sub>, BaO, KCl<br><br>Розглянь рівняння реакцій утворення деяких йонних сполук:<br>а) взаємодія магнію з йодом:<br> |
| | | | |
| - | <br>Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають '''''йонним зв'язком'''''.<br>Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.<br>Приклади речовин з йонним типом хімічного зв 'язку:<br>NaCl, NaBr, NaF, MgCl<sub>2</sub>, MgS, NaOH, Li<sub>2</sub>O, Ca<sub>3</sub>P<sub>2</sub>, AlCl<sub>3</sub>, BaO, KCl<br><br>Розглянь рівняння реакцій утворення деяких йонних сполук:<br>а) взаємодія магнію з йодом:<br>
| + | [[Image:Взаємодія магнію з йодом.jpg|формула. фото]]<br>б) окиснення кальцію:<br> |
| | | | |
| - | [[Image:Взаємодія магнію з йодом.jpg]]<br>б) окиснення кальцію:<br> | + | [[Image:Окиснення кальцію.jpg|формула. фото]]<br>в) горіння алюмінію в бромі:<br><br>Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».<br>Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.<br><br><br>'''Bисновки'''<br>Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.<br>Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.<br>Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.<br><br><br>'''Завдання для самоконтролю'''<br>''1. Що таке йонний зв'язок? Між якими елементами він виникає?<br>2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.<br>3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na<sub>2</sub>S; в) у кальцій нітриді Ca<sub>3</sub>N<sub>2</sub>. Поясни схеми.<br>4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н<sub>2</sub>0, РН<sub>3</sub>, CaS, ZnCI<sub>2</sub>, SiH<sub>4</sub>, ССl<sub>4</sub>.<br>5. Запиши формули сполук, до складу яких входять такі йони: a) Na<sup>+</sup> і Вr<sup>-</sup>; б) Са<sup>2+</sup> і Сl<sup>-</sup>; в) К<sup>+</sup> і S<sup>2+</sup>. Назви ці сполуки.<br>6. Яскраво виражений йонний зв'язок у парі атомів<br>(а) K—F; (в) F—F;<br>(б) 0—F; (г) P—F.<br>7. Хлор у сполуках утворює йонні зв'язки з<br>(а) К; (б) Н; (в) Са; (г) С.'' |
| | | | |
| - | [[Image:Окиснення кальцію.jpg]]<br>в) горіння алюмінію в бромі:<br>[[Image:Горіння алюмінію в бромі .jpg]]<br>Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».<br>Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.<br><br><br><u>Bисновки</u><br>Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.<br>Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.<br>Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.<br><br><br><u>Завдання для самоконтролю</u><br>1. Що таке йонний зв'язок? Між якими елементами він виникає?<br>2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.<br>3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na<sub>2</sub>S; в) у кальцій нітриді Ca<sub>3</sub>N<sub>2</sub>. Поясни схеми.<br>4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н<sub>2</sub>0, РН<sub>3</sub>, CaS, ZnCI<sub>2</sub>, SiH<sub>4</sub>, ССl<sub>4</sub>.<br>5. Запиши формули сполук, до складу яких входять такі йони: a) Na<sup>+</sup> і Вr<sup>-</sup>; б) Са<sup>2+</sup> і Сl<sup>-</sup>; в) К<sup>+</sup> і S<sup>2+</sup>. Назви ці сполуки.<br>6. Яскраво виражений йонний зв'язок у парі атомів<br>(а) K—F; (в) F—F;<br>(б) 0—F; (г) P—F.<br>7. Хлор у сполуках утворює йонні зв'язки з<br>(а) К; (б) Н; (в) Са; (г) С.
| + | <br>'''Додаткові завдання'''<br>''8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це<br>(а) Cu i F; (в) Na і F;<br>(б) C i N; (г) Li i Н.<br>9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.<br>10*. У натрій гідроксиді йонними є зв'язки<br>(а) між Натрієм і Оксигеном;<br>(б) між Гідрогеном і Оксигеном;<br>(в) між Натрієм і Гідрогеном;<br>(г) усі зв'язки.<br>11*. Порівняй будову йонів Мg<sup>2+</sup> і F<sup>-</sup> з будовою атома Неону. Знайди подібні й відмінні ознаки.<br>12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?<br>13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?''<br> |
| | | | |
| - | <br><u>Додаткові завдання</u><br>8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це<br>(а) Cu i F; (в) Na і F;<br>(б) C i N; (г) Li i Н.<br>9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.<br>10*. У натрій гідроксиді йонними є зв'язки<br>(а) між Натрієм і Оксигеном;<br>(б) між Гідрогеном і Оксигеном;<br>(в) між Натрієм і Гідрогеном;<br>(г) усі зв'язки.<br>11*. Порівняй будову йонів Мg<sup>2+</sup> і F<sup>-</sup> з будовою атома Неону. Знайди подібні й відмінні ознаки.<br>12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?<br>13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?<br>
| |
| | | | |
| - | ----
| |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту | + | ''Н.М. Буринська, [[Хімія_8_клас|Хімія, 8 клас]]<br>Вислано читачами інтернет-сайту'' |
| | | | |
| | <br> <sub>Плани уроків з [[Хімія|хімії]], підручники та книги шкільної програми [[Гіпермаркет Знань - перший в світі!|онлайн]], хімія 8 клас</sub> <br> | | <br> <sub>Плани уроків з [[Хімія|хімії]], підручники та книги шкільної програми [[Гіпермаркет Знань - перший в світі!|онлайн]], хімія 8 клас</sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> | | <br> |
Текущая версия на 08:34, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Йонний зв’язок
Ти вже розумієш, як взаємодіють між собою неметали: між їх атомами встановлюється ковалентний зв'язок. А тепер розглянемо, як взаємодіють неметали з металами. Атоми цих елементів дуже відрізняються за своєю електронегативністю, тому спільна електронна пара, яка утворює зв'язок, настільки змішується до атома з більшою електронегативністю, що практично належить тільки цьому атому. Наприклад, натрій взаємодіє з хлором:
2Na + Сl2 = 2NaCl
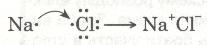
Зовнішній енергетичний рівень атома Натрію (як і будь-якого лужного металу) далекий від завершення — містить один електрон, який слабко зв'язаний з ядром, бо великий радіус атома. Тому під час хімічних перетворень атоми Натрію легко втрачають єдиний валентний електрон і перетворюються з нейтральних атомів на позитивно заряджені йони:
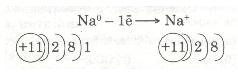
Передостанній енергетичний рівень з восьми електронів стає останнім, зовнішнім, і атом Натрію набуває стійкого енергетичного рівня, подібно до атома Неону Ne.
Зовнішній енергетичний рівень атома Хлору має сім валентних електронів. Він близький до завершення. Радіус атома Хлору невеликий, а електронегативність дуже велика. Тому атом Хлору приймає один електрон від атома Натрію, добудовуючи зовнішній рівень до октету (вось-миелектронної структури). У цьому разі атом Хлору набуває негативного заряду -1, перетворюючись на негативно заряджений йон:
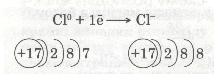
Отже, валентний електрон атома Натрію під час взаємодії з атомом Хлору повністю переходить на зовнішній рівень атома Хлору. Схематично цей процес можна передати так:
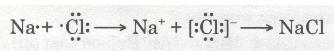
Йони — це електрично заряджені частинки речовини, що утворилися з атомів або атомних груп унаслідок втрати або приєднання електронів.
Різнойменно заряджені йони Натрію Na+ і Хлору Сl-, притягуючись один до одного завдяки наявності сили притягання, утворюють сполуку — натрій хлорид NaCl. Цей процес можна записати ще й у такий спосіб:
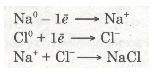
Хімічний зв'язок, утворений за допомогою взаємодії йонів, називають йонним зв'язком.
Речовини, що складаються з йонів, називаються йонними сполуками. Вони утворені типовими металами і типовими неметалами. Атоми металів віддають електрони, а атоми неметалів їх приймають.
Приклади речовин з йонним типом хімічного зв 'язку:
NaCl, NaBr, NaF, MgCl2, MgS, NaOH, Li2O, Ca3P2, AlCl3, BaO, KCl
Розглянь рівняння реакцій утворення деяких йонних сполук:
а) взаємодія магнію з йодом:
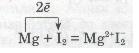
б) окиснення кальцію:
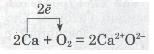
в) горіння алюмінію в бромі:
Зверни увагу, заряд йонів позначають зверху, праворуч від хімічного знака: спочатку — цифру, а потім — знак «+» aбо «-».
Ионний зв'язок є крайнім випадком полярного ковалентного зв'язку. Ионні сполуки в твердому стані — кристалічні речовини. У йонних кристалах електростатичне поле кожного йона поширюється у всіх напрямках, тому ионний зв'язок не має напрямленості.
Bисновки
Йонний зв'язок обумовлений взаємодією між різнойменно зарядженими йонами.
Сполуки з йонним типом хімічного зв'язку виникають у тому разі, коли взаємодіють атоми елементів з дуже відмінною електронегативністю — атоми типового металу і типового неметалу, тобто елементи, розміщені на початку і в кінці періодів періодичної системи. Найтиповіший йонний зв'язок виникає в солях, утворених лужними металами і галогенами.
Йонний зв'язок і неполярний ковалентний зв'язок — два крайні випадки розподілу електронної густини. Неполярному зв'язку відповідає рівномірний розподіл спільної двохелектронної хмари між однаковими атомами. Якщо зв'язок йонний, навпаки, спільна електронна пара практично повністю належить одному з атомів, у якого електронегативність більша.
Завдання для самоконтролю
1. Що таке йонний зв'язок? Між якими елементами він виникає?
2. Чим відрізняється йонний зв'язок від ковалентного полярного і неполярного? Відповідь поясни.
3. Напиши схеми утворення йонного зв'язку: а) у калій броміді КВr; б) у натрій сульфіді Na2S; в) у кальцій нітриді Ca3N2. Поясни схеми.
4. Серед наведених формул речовин зазнач сполуки з йонним, полярним і неполярним ковалентними зв'язками і поясни їх будову: НІ, Н20, РН3, CaS, ZnCI2, SiH4, ССl4.
5. Запиши формули сполук, до складу яких входять такі йони: a) Na+ і Вr-; б) Са2+ і Сl-; в) К+ і S2+. Назви ці сполуки.
6. Яскраво виражений йонний зв'язок у парі атомів
(а) K—F; (в) F—F;
(б) 0—F; (г) P—F.
7. Хлор у сполуках утворює йонні зв'язки з
(а) К; (б) Н; (в) Са; (г) С.
Додаткові завдання
8. Пара елементів, атоми яких під час хімічної взаємодії виявляють максимальну тенденцію до утворення сполуки з йонним зв'язком, — це
(а) Cu i F; (в) Na і F;
(б) C i N; (г) Li i Н.
9. Між атомами елементів з протонними числами 3 і 9 виникає зв'язок (а) ковалентний полярний; (б) ковалентний неполярний; (в) ионний.
10*. У натрій гідроксиді йонними є зв'язки
(а) між Натрієм і Оксигеном;
(б) між Гідрогеном і Оксигеном;
(в) між Натрієм і Гідрогеном;
(г) усі зв'язки.
11*. Порівняй будову йонів Мg2+ і F- з будовою атома Неону. Знайди подібні й відмінні ознаки.
12*. На що перетворився б атом Аргону, якби з його ядра зник один протон, а електронна оболонка залишилася без змін?
13*. В якої з двох речовин: (a) LiH; (б) CsH ионний тип хімічного зв'язку між атомами виражений сильніше? Чому?
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Плани уроків з хімії, підручники та книги шкільної програми онлайн, хімія 8 клас
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|